Enzimas 1 (soluciones)
1.- Defina: enzima, sustrato y centro activo.
• Las enzimas son catalizadores específicos de las reacciones químicas que tienen lugar en los seres vivos. Las enzimas son, pues, biocatalizadores. Desde el punto de vista químico, todas las enzimas son proteínas globulares (excepto algunos tipos de ARN con capacidad catalítica, denominados ribozimas).
• Se llama sustrato al compuesto sobre el que actúa la enzima y, como consecuencia de la catálisis, queda transformado en producto.
• Centro activo es la zona de la superficie enzimática donde tiene lugar la unión con el sustrato y la catálisis del mismo. Una vez originado el producto, la enzima queda libre y puede realizar un nuevo ciclo de reacción.
Nota.- En muchos libros se escribe los enzimas (en vez de las enzimas), lo cual es igualmente correcto.
2.- ¿Cuál es la característica que diferencia a las enzimas del resto de las proteínas?
Las enzimas inducen modificaciones químicas en los sustratos a los que se unen, ya sea por ruptura, formación o redistribución de sus enlaces covalentes, o por introducción o pérdida de algún grupo funcional. El resultado de esta unión enzima-sustrato es que el sustrato se transforma en otra molécula llamada producto.
3.- ¿Puede ser una misma molécula sustrato y producto?
En la vía metabólica “A —› B —› C” se observa que B es el producto de la reacción A —› B, pero a su vez es el sustrato de la siguiente, B —› C.
También existe ambigüedad cuando una reacción es reversible, por ejemplo, M ‹—› N, ya que la molécula sustrato o producto depende del sentido considerado.
4.- Aclare el significado de la siguiente expresión:
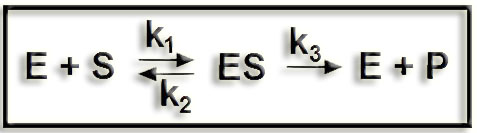
Esta expresión se refiere al mecanismo general de catálisis enzimática.
Las enzimas (E) catalizan reacciones en las que una o más moléculas de sustrato (S) se transforman en uno o varios productos (P). Esto requiere la formación transitoria del llamado complejo enzima-sustrato (ES). En este complejo las moléculas de sustrato deben quedar correctamente orientadas en el centro activo para que tenga lugar la acción catalítica y, posteriormente, la liberación de los productos.
Las enzimas intervienen a concentraciones muy bajas y aceleran las reacciones en las que participan, sin sufrir por ello modificación alguna.
• k1 = constante de velocidad de formación del complejo ES
• k2 = constante de velocidad de disociación del complejo ES
• k3 = constante de velocidad de disociación de ES para dar E y P
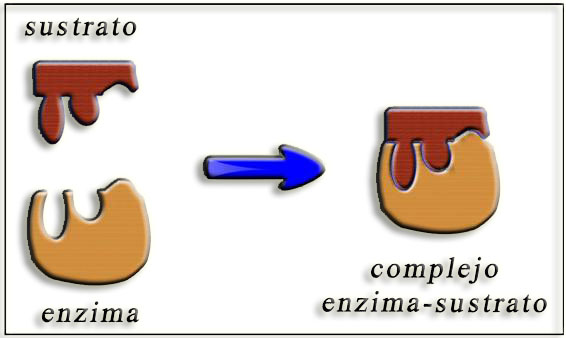
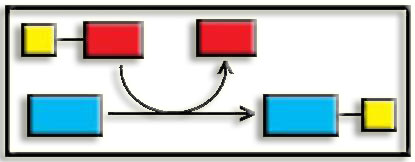
5.- ¿A qué se refiere el símil de la llave y la cerradura? Presente un esquema.
Este símil fue utilizado por Emil Fischer para describir la complementariedad geométrica entre el sustrato (“llave”) y la enzima (“cerradura”). Cuando el sustrato ha encajado en el centro activo queda constituido el complejo enzima-sustrato. Esquema:
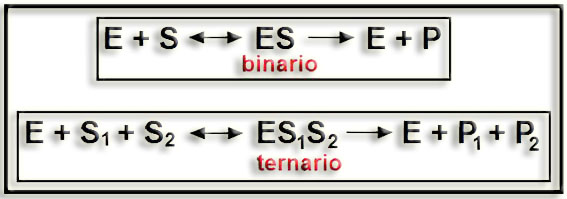
6.- ¿Qué es el complejo enzima-sustrato? ¿Es siempre binario dicho complejo?
• El denominado complejo enzima-sustrato es una asociación muy estrecha y transitoria que se establece entre el centro activo de la enzima y la molécula de sustrato. En la formación de dicho complejo se hallan implicados enlaces iónicos, puentes de hidrógeno y fuerzas de Van der Waals.
• Considerando que la enzima posee un único centro activo, el complejo enzima-sustrato puede ser binario (ES) o ternario (ES1S2), dependiendo del tipo de reacción:
7.- ¿Cuál es la propiedad común que presentan todos los catalizadores? ¿Cuáles son las principales diferencias entre las enzimas y los catalizadores no biológicos?
Todos los catalizadores se caracterizan por intervenir a concentraciones muy bajas y acelerar las reacciones en las que participan, sin sufrir por ello modificación alguna.
Las características diferenciadoras de las enzimas o biocatalizadores son:
• Alta especificidad (generalmente actúan en una sola reacción).
• Alta actividad (algunas enzimas aumentan la velocidad de reacción en más de un millón de veces).
• Actúan siempre a la temperatura del ser vivo.
• Presentan una masa molecular muy elevada.
8.- ¿Qué entiende por especificidad enzimática?
La especificidad es la propiedad más sobresaliente de las enzimas. Se refiere a que cada enzima cataliza un solo tipo de reacción, actuando sobre un único sustrato o sobre un grupo muy reducido de ellos.
Hay distintos grados de especificidad. La enzima sacarasa es muy específica: hidroliza (rompe) el enlace O-glucosídico de la sacarosa, que es su sustrato natural, originando glucosa y fructosa.
La sacarasa también puede actuar sobre la isomaltosa, que es un sustrato análogo, originando dos glucosas. La actividad de la enzima es máxima cuando actúa sobre el sustrato natural, siendo menor la eficacia sobre los sustratos análogos.
Entre las enzimas poco específicas están las proteasas digestivas, por ejemplo, la quimotripsina, que rompe los enlaces amida de proteínas y péptidos de muy diverso tipo.
9.- Características y función del centro activo de las enzimas.
• El centro activo constituye una parte muy pequeña de la enzima (en torno al 5 % de la superficie total). Suele estar formado por menos de diez aminoácidos que, aunque distantes en la cadena peptídica, quedan próximos debido a los repliegues de la misma. Presenta una estructura tridimensional en forma de cavidad, que facilita la unión con el sustrato y dificulta que lo haga otro tipo de moléculas.
Cada enzima tiene uno o más centros activos, es decir, cavidades en su superficie donde interaccionan específicamente con los sustratos, siendo ahí donde tiene lugar la catálisis (transformación del sustrato en producto).
• El centro activo tiene dos funciones: fijación del sustrato y catálisis (generalmente cada función depende de aminoácidos diferentes). Unos aminoácidos son los encargados de la unión estableciendo con el sustrato enlaces débiles (iónicos, puentes de hidrógeno y fuerzas de Van der Waals), en al menos tres puntos. Otros aminoácidos son los directamente implicados en la catálisis, es decir, en el mecanismo de la reacción, siendo responsables de la transformación del sustrato en producto.
10.- ¿Son igualmente importantes todos los aminoácidos para llevar a cabo la catálisis enzimática?
La presencia en el centro activo de los aminoácidos implicados en la catálisis enzimática es muchísimo más frecuente en unos casos que en otros. De los 20 aminoácidos que integran las proteínas enzimáticas, sólo algunos de ellos intervienen directamente en la catálisis a través de determinados grupos funcionales de su molécula.
En el centro activo de las enzimas se hallan con mayor frecuencia algunos de los siguientes: aspártico, cisteína, glutámico, histidina, lisina y serina.
11.- Interprete el esquema siguiente y nombre las partes numeradas.
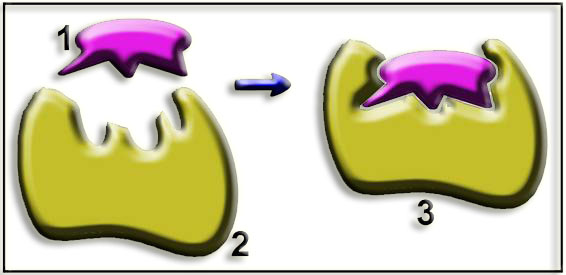
1 = sustrato. 2 = enzima. 3 = complejo enzima-sustrato
Se trata del modelo denominado “ajuste inducido”, es decir, la enzima modifica su conformación espacial adaptándose el centro activo a la molécula de sustrato para formar el complejo.
12.- Interprete el esquema adjunto (E = enzima).
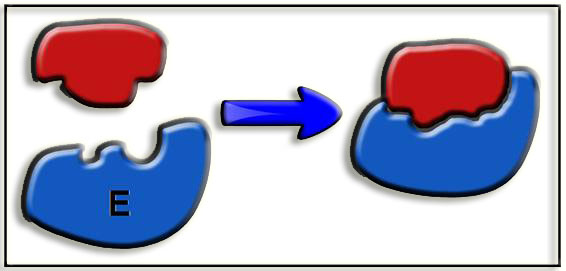
Sobre la interacción de determinados sustratos y enzimas se ha propuesto el modelo denominado “apretón de manos”, observándose en el esquema que tanto la enzima como el sustrato modifican su forma al acoplarse y constituir el complejo enzima-sustrato.
13.- En algunos libros aparece la expresión adjunta. Aclare el significado de tales términos.

Se trata de una expresión más detallada del modo de acción de las enzimas.
E + S = enzima libre más el sustrato
ES = complejo enzima-sustrato
ES* = complejo enzima-sustrato activado
EP = complejo enzima-producto
E + P = enzima libre más el producto de la reacción
14.- Interprete el siguiente esquema. Aclare el significado de las letras (A, a) y de los números (1, 2, 3). Escriba una conclusión.
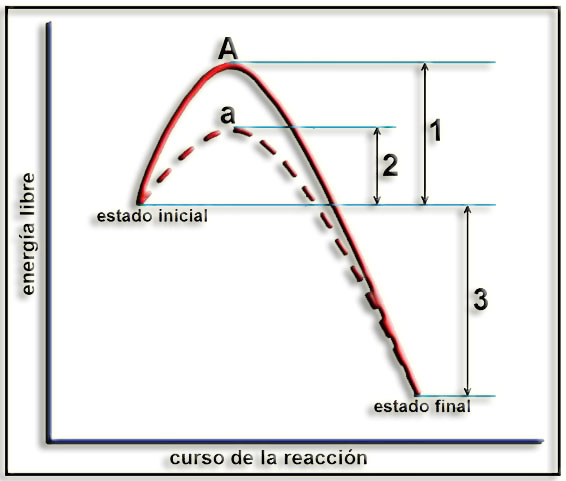
En las reacciones espontáneas, los productos finales tienen menos energía libre que los reactantes, aunque hay que suministrar un aporte energético para que transcurra la reacción. Este aporte, al que a llamamos energía de activación, es necesario para alcanzar un estado de transición o activado, que facilita la reacción al aumentar la energía cinética de los reactantes, posibilitando que se rompan enlaces químicos y se puedan formar otros nuevos.
Cuanto menor sea la energía de activación más fácilmente transcurre la reacción. En la mayoría de los procesos realizados en los laboratorios la energía de activación se aporta en forma de calor.
Los catalizadores facilitan y aceleran las reacciones ya que disminuyen la energía de activación.
• A = estado activado de la reacción sin catalizador
• a = estado activado de la reacción catalizada
• 1 = energía de activación sin catalizador
• 2 = energía de activación con catalizador
• 3 = energía liberada en la reacción (proceso exergónico)
Conclusión: las enzimas aumentan la velocidad con que una reacción química alcanza el equilibrio puesto que disminuyen la energía de activación (cantidad de energía necesaria para activar las moléculas reaccionantes y completar la reacción).
15.- En ciertos textos se lee que algunas enzimas catalizan reacciones “Uni-Uni” (uni-uni), “Bi-Bi” (bi-bi) u otra combinada. Haga un esquema para aclarar su significado.
La reacción más sencilla catalizada por una enzima (E) es aquella en la que una molécula de sustrato, S, se convierte en otra de producto, P (“Uni-Uni”). Sin embargo, determinadas enzimas catalizan reacciones en las que la estequiometría es más compleja.
Esquemáticamente:
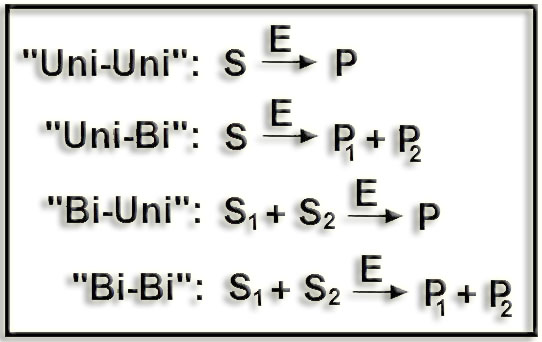
16.- Nombre y función de “EC 5.3.1.1” (busque en Internet).
Se trata de la enzima triosafosfato isomerasa, que cataliza la interconversión de las triosas fosfato en la vía glucolítica.
La reacción es (“Uni-Uni”):

17.- ¿Qué reacción cataliza la hexoquinasa (EC 2.7.1.1)?
La hexoquinasa (EC 2.7.1.1) es una enzima que cataliza la transferencia de un grupo fosfato desde el ATP a una hexosa, resultando ADP y hexosa fosfato.

18.- Aclare el significado de “EC 2.7.1.2”.
Aunque inicialmente las enzimas recibieron el nombre asignado por su descubridor, dado que el número de ellas iba en continuo aumento, se hizo preciso sistematizar la nomenclatura. La Unión Internacional de Bioquímica estableció un sistema inequívoco, basado en anteponer las letras mayúsculas EC (Enzyme Commission) a una serie de 4 números separados por puntos: clase, subclase, sub-subclase y otro en función del sustrato, que se asigna a la enzima correspondiente.
He aquí el significado de “EC 2.7.1.2”:
• EC = Enzyme Commission
• 2 = clase (transferasas).
• 7 = subclase (fosfotransferasas).
• 1 = sub-subclase. Esta subdivisión es la que corresponde al grupo hidroxilo como aceptor del fosfato.
• 2 = asignado a la glucoquinasa: D-glucosa como sustrato aceptor del grupo fosfato.
La función de la glucoquinasa es muy específica y consiste en catalizar la transferencia del grupo fosfato terminal del ATP a la glucosa, resultando ADP y glucosa fosfato.

Nota.- Aunque la hexoquinasa también realiza esta función, es menos específica que la glucoquinasa.
19.- Clasificación de las enzimas (ilustre con esquemas, sin fórmulas).
La Unión Internacional de Bioquímica y Biología Molecular propuso una clasificación de las enzimas en seis grandes grupos o clases, según el tipo de reacción que catalizan:
1. Óxido-reductasas (oxidorreductasas). Catalizan reacciones de óxido-reducción (pérdida o ganancia de electrones).
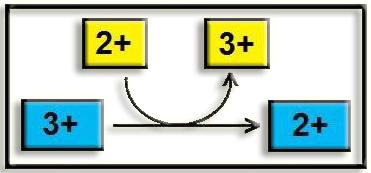
2. Transferasas. Catalizan la transferencia de radicales o grupos funcionales de unas moléculas a otras.
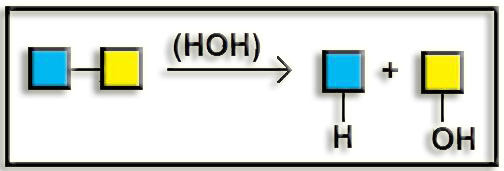
3. Hidrolasas. Catalizan reacciones hidrolíticas.
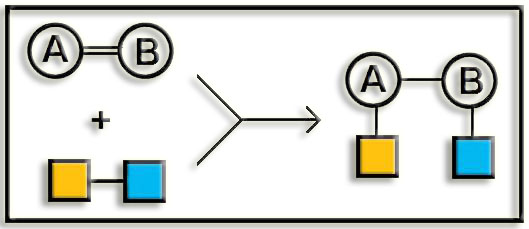
4. Liasas. Catalizan rupturas moleculares no hidrolíticas, así como la adición de grupos funcionales a moléculas que poseen un doble enlace (el cual desaparece). Por ejemplo:
5. Isomerasas. Catalizan reacciones de isomerización.
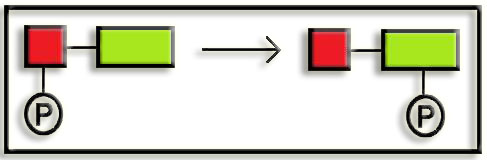
6. Ligasas. Catalizan la unión de moléculas mediante el aporte energético del ATP (o compuesto similar).
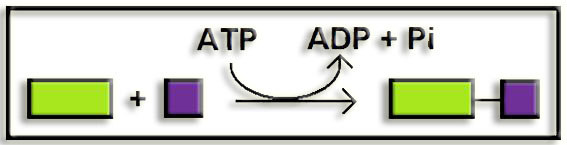
20.- (Internet: “www.chem.qmul.ac.uk/iubmb/enzyme”). ¿En cuántas subclases se dividen las 6 clases de enzimas?
Clases y número de subclases:
• Clase 1. Óxido-reductasas. Se divide en 25 subclases.
• Clase 2. Transferasas. Se divide en 9 subclases.
• Clase 3. Hidrolasas. Se divide en 13 subclases.
• Clase 4. Liasas. Se divide en 7 subclases.
• Clase 5. Isomerasas. Se divide en 6 subclases.
• Clase 6. Ligasas. Se divide en 6 subclases.
21.- Escriba en un buscador de Internet “EC 1.1.1.1”. Luego haga lo propio con “EC 4.1.1.1” y “EC 6.4.1.1”. Cite simplemente los nombres correspondientes.
Nombre de las enzimas:
• EC 1.1.1.1 = alcohol deshidrogenasa
• EC 4.1.1.1 = piruvato descarboxilasa
• EC 6.4.1.1 = piruvato carboxilasa
22.- (Internet: “EC 3.1.1.7”). Dado el proceso adjunto, indique el nombre de la enzima y el de los compuestos A, B, C y D.
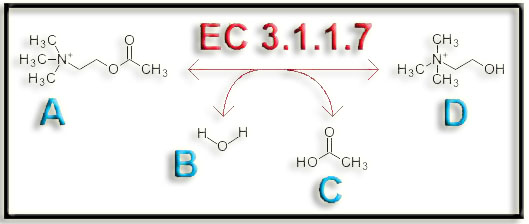
“EC 3.1.17” corresponde a la enzima acetilcolinesterasa.
A = acetilcolina (neurotransmisor)
B = agua
C = acético (acetato)
D = colina
Nota.- Los insecticidas organofosforados pueden ocasionar accidentes mortales entre los agricultores por su uso indebido. La razón es que tales compuestos actúan como inhibidores irreversibles de la enzima acetilcolinesterasa, por lo que el efecto continuado de la sustancia neurotransmisora (acetilcolina), al no quedar inactivada, provocará tetania.
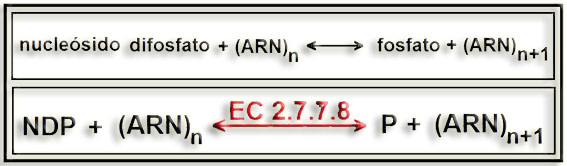
23.- ¿Cuál es la enzima de Ochoa? (Busque en Internet). ¿Por qué fue tan importante?
• Es la polinucleótido fosforilasa, también llamada polirribonucleótido nucleotidiltransferasa (EC 2.7.7.8). Cataliza la siguiente reacción:
• La enzima de Ochoa fue muy importante porque sirvió para esclarecer el código genético, que fue descifrado mediante experimentos en los que se emplearon secuencias conocidas de ARN sintetizadas de manera artificial con dicha enzima. Estas cadenas de ARN se utilizaron como iniciadores en sistemas “in vitro”, en los que los ribosomas inician libremente la síntesis de proteínas.
24.- ¿Conoce alguna enzima que sea bifuncional? Justifique la respuesta.
En general, las enzimas son altamente específicas. Sin embargo, la ribulosa difosfato carboxilasa (EC 4.1.1.39), también llamada “rubisco” (ver nota), que se halla en el estroma del cloroplasto, puede actuar como carboxilasa, catalizando en la fotosíntesis la fijación del CO2 a la ribulosa difosfato, o bien como “oxigenasa” (en la fotorrespiración), cuando la concentración de CO2 es muy baja, y la de oxígeno, alta. Las reacciones son:
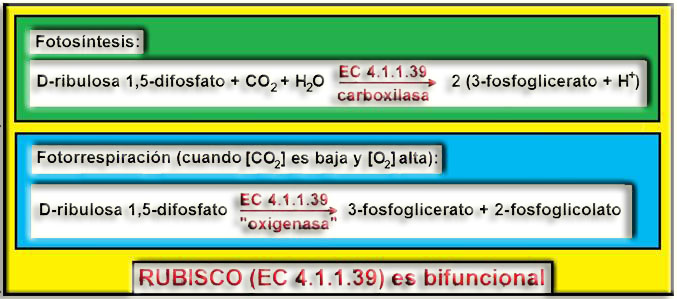
Rubisco es una enzima de la clase 4 (liasas): “EC 4.1.1.39”. Aunque en las condiciones anteriormente citadas puede comportarse como “oxigenasa” (u oxidasa), no tiene nada que ver con las enzimas de la clase 1 (oxidorreductasas). Lo que ocurre es que el O2 compite con el CO2 como sustrato y cuando se fija a la enzima “parece que la oxigena”, pero no hay proceso redox. En este caso la ribulosa (cetopentosa) se rompe en dos moléculas de 3 y 2 átomos de carbono, iniciando la vía metabólica llamada fotorrespiración, de forma que tras una serie de reacciones en varios orgánulos de la célula vegetal (cloroplasto, peroxisoma, mitocondria) se desprende CO2.
(*). Nota.- Rubisco aparece en los libros escrita de diversas maneras (rubisCO, RuBisCO, RUBISCO). Es un acrónimo de ribulosa (ru), difosfato o “bisphosphate” (bis), carboxilasa (c)- oxigenasa (o).
25.- Interprete el esquema adjunto.
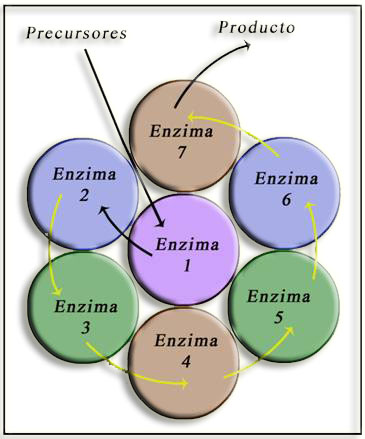
Se trata de un complejo multienzimático, esto es, una asociación de enzimas que intervienen en una misma ruta metabólica, de forma que el producto de una es el sustrato de la siguiente. Esta disposición facilita que los sucesivos sustratos encuentren con mayor probabilidad la enzima que los ha de catalizar, lo cual mejora enormemente la eficacia del proceso para sintetizar el producto final.
26.- ¿Qué son metabolitos?
Metabolitos o intermediarios metabólicos son los compuestos que se generan en las vías o rutas metabólicas (serie de reacciones enzimáticas consecutivas).
Considerando a modo de ejemplo la ruta metabólica A—›B—›C—›D—›E—›F, se observa que entre el sustrato inicial A y el producto final F se han originado los intermediarios B, C, D y E.
27.- Aclare el significado de esta frase: “Las enzimas son las reinas del metabolismo”.
Esta frase se refiere a que las reacciones metabólicas están catalizadas por enzimas, sin las cuales la velocidad de tales reacciones sería muy lenta e incompatible con la vida.
Además, existen enzimas que modulan la actividad variando la velocidad de numerosos procesos metabólicos, todo ello en función de las necesidades de la célula o del organismo.
En resumen: las enzimas ejercen el control del metabolismo posibilitando las reacciones y la regulación de tales procesos.
28.- ¿Cuál es el fundamento para utilizar marcadores enzimáticos en los análisis clínicos? Ponga un ejemplo.
• Algunas enzimas son propias de las células de ciertos tejidos u órganos, pero carecen de función en la sangre.Cuando una o más de tales enzimas se detectan en un análisis sanguíneo sirven como indicador de una posible lesión, pues cabe deducir que el contenido intracelular se ha vertido al medio por necrosis u otra causa.
• Por ejemplo, la transaminasa glutámico-oxalacética (GOT), también llamada aspartato transaminasa (AST), que se encuentra, especialmente, en el corazón, hígado y tejido muscular. Su elevación en plasma es indicativa de una lesión tisular: infarto, hepatopatía, miopatías, etc.
29.- Nombre y función de: “EC 2.6.1.1” (busque en Internet).
• Se trata de la aspartato aminotransferasa (ASAT), antes conocida como transaminasa glutámico-oxalacética (GOT), también llamada aspartato transaminasa (AST).
• Es una enzima aminotransferasa que cataliza la transformación de dos moléculas de sustrato en otras dos de producto (estequiometría “bi-bi”). Transfiere un grupo amino desde el aspartato al oxoglutarato formándose glutamato y oxalacetato.
La reacción es:

Nota.- Esta enzima se utiliza como marcador en clínica, junto a otros parámetros, para evaluar la función del hígado.
30.- Nombre y función de: “EC 2.6.1.2” (busque en Internet).
• Se trata de la alanina aminotransferasa (ALAT), antes conocida como transaminasa glutámico-pirúvica (GPT), también llamada alanina transaminasa (ALT).
• Esta enzima cataliza la transferencia de un grupo amino desde la alanina al α-cetoglutarato, resultando piruvato y glutamato.

Nota.- ALAT es unaenzimaaminotransferasa con gran concentración en elhígadoy, en menor cuantía, en los riñones, corazón y músculos. Cuando hay una lesión de estos órganos la enzima es liberada a la sangre y aparece elevada en los análisis.




