Enzimas 2 (soluciones)
1.- ¿Qué son los inhibidores enzimáticos? Tipos de inhibición.
Los inhibidores son moléculas que frenan de forma específica la actividad de las enzimas.
Se consideran los siguientes tipos de inhibición:
Inhibición reversible. Cuando la unión del inhibidor con la enzima es temporal y la actividad enzimática se puede recuperar.
• Competitiva. El inhibidor es una molécula con una conformación espacial muy similar a la del sustrato, de formaque compite con éste por alojarse en el centro activo, impidiendo así la formación del complejo enzima-sustrato.
• No competitiva. El inhibidor se une a otra región distinta del centro activo y provoca un cambio en la conformación de la enzima que da lugar a una disminución de su actividad.
• Incompetitiva (acompetitiva). El inhibidor se une al complejo enzima-sustrato e impide la formación del producto.
Inhibición irreversible. Cuando el inhibidor se une de modo permanente a determinados grupos del centro activo de una enzima anulando su capacidad catalítica. Por ejemplo, los insecticidas organofosforados son inhibidores irreversibles de la enzima acetilcolinesterasa. Esto ocasiona accidentes mortales entre los agricultores por su uso indebido.
2.- Aclare el significado de las figuras A y B.
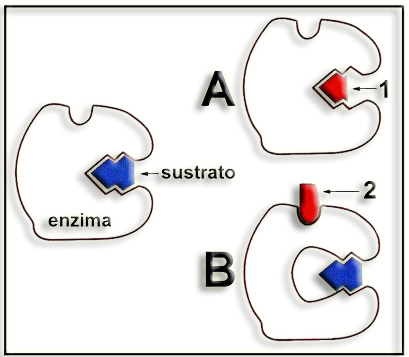
A = inhibición competitiva. El inhibidor competitivo (1) es una molécula tan parecida al sustrato que “compite” por alojarse en el centro activo, impidiendo así la fijación del sustrato y su posterior transformación.
B = inhibición no competitiva. En este caso, el inhibidor no competitivo (2) se une a la enzima en otra región distinta del centro activo y provoca un cambio conformacional que dificulta la interacción con el sustrato, por lo que también disminuye la actividad enzimática.
3.- Interprete el esquema adjunto.
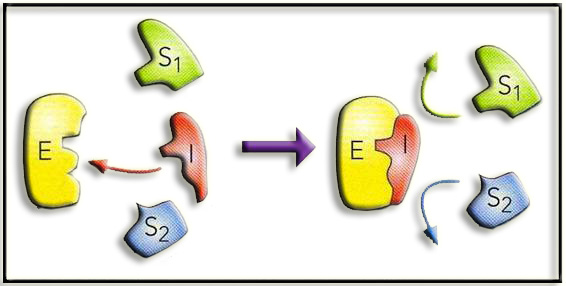
Este esquema sirve para ilustrar el concepto de inhibición irreversible. El inhibidor (I) se une de modo permanente a determinados grupos del centro activo de la enzima (E) y anula su capacidad catalítica puesto que impide la unión de los sustratos (S1 y S2).
4.- Redacte un breve comentario sobre las figuras A y B.
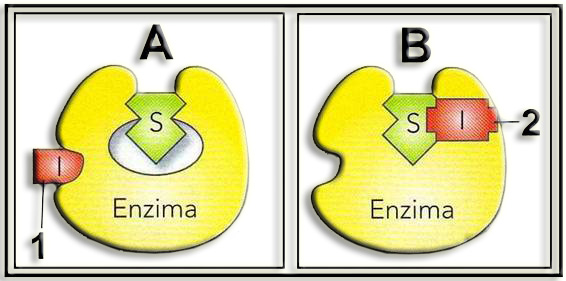
A = inhibición no competitiva. El inhibidor no competitivo (1) se une a la enzima en otra región distinta del centro activo y provoca un cambio en la conformación que dificulta la interacción con el sustrato (S), lo cual provoca la disminución de la actividad enzimática.
B = inhibición incompetitiva (acompetitiva). En este caso, el llamado inhibidor incompetitivo (2), se une al complejo enzima-sustrato, bloqueando la catálisis e impidiendo la formación del producto.
5.- ¿Sobre qué trata la cinética enzimática? Indique el significado de las letras minúsculas en el gráfico adjunto.
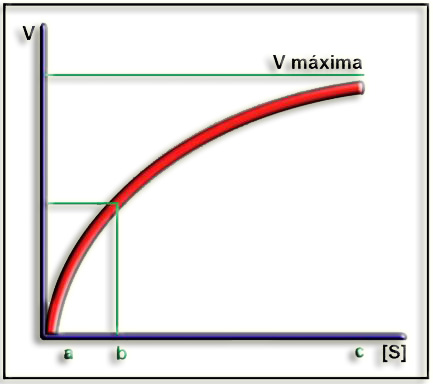
La cinética enzimática estudia la velocidad de las reacciones catalizadas por enzimas y deduce, a partir de determinados parámetros, la actividad de la enzima, su afinidad por el sustrato y los mecanismos a través de los cuales lleva a cabo la catálisis.
En el eje de abscisas se ha representado la concentración de sustrato, y en el de ordenadas, la velocidad de reacción, resultando una curva hiperbólica que es característica de la mayoría de las enzimas (cinética de Michaelis-Menten).
(a). Cuando la concentración de sustrato es baja la velocidad aumenta de manera prácticamente lineal.
(b). Este punto representa la constante de Michaelis-Menten, es decir, la concentración de sustrato para la cual la velocidad de reacción es la mitad de la máxima.
(c). La velocidad apenas aumenta cuando [S] es muy alta (zona de saturación).
6.- ¿Qué representa la ecuación adjunta?
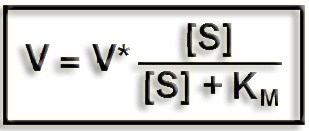
Se trata de la ecuación de Michaelis-Menten (llamada coloquialmente “ecuación MM”), siendo:
V = velocidad inicial de la reacción
V* = velocidad máxima
[S] = concentración de sustrato libre
KM = constante de Michaelis-Menten
Esta ecuación permite explicar las características cinéticas de muchas reacciones enzimáticas con un solo sustrato. La constante (KM) refleja la afinidad de la enzima por el sustrato.
7.- Simplifique la ecuación de Michaelis-Menten para los siguientes casos: a) [S] mucho menor que KM; b) [S] igual a KM; c) [S] mucho mayor que KM.
Ecuación de Michaelis-Menten:
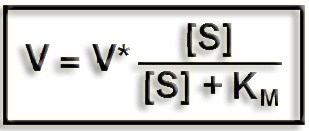
Recordemos que:
V = velocidad inicial de la reacción
V* = velocidad máxima
[S] = concentración de sustrato libre
KM = constante de Michaelis-Menten
La triple propuesta del enunciado es:
Caso a). Si [S] es mucho menor que KM puede considerarse que ([S] + KM) equivale a KM y la ecuación queda así:
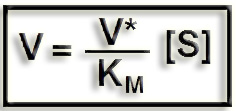
Esto quiere decir que la velocidad es proporcional a [S].
Caso b). Si [S] es igual a KM, entonces ([S] + KM) equivale a 2 [S], resultando:

O sea: KM corresponde a la concentración de sustrato a la que la velocidad de la reacción es la mitad de la máxima.
Caso c). Si [S] es mucho mayor que KM, entonces ([S] + KM) equivale a [S], resultando al simplificar que la velocidad inicial se aproxima al valor de V* (velocidad máxima), lo que corresponde a la zona de saturación de la gráfica de la cinética enzimática.
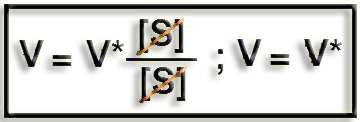
8.- Defina la KM. ¿Cuál es su significado?
La KM es la constante de Michaelis-Menten, que se define como la concentración de sustrato para la cual la velocidad de reacción es la mitad de la máxima.
La KM es un indicador de la afinidad enzima-sustrato, significando que cuanto menor es KM, mayor es la afinidad de la enzima por el sustrato.
9.- Aclare la diferencia entre inhibición competitiva y no competitiva con respecto a la KM.
Las enzimas que siguen la cinética de Michaelis, en presencia de inhibidor competitivo, tienen la misma velocidad máxima y diferente KM, mientras que en presencia de inhibidor no competitivo, tienen la misma KM puesto que el sustrato mantiene su capacidad de unión a la enzima, pero diferente velocidad máxima ya que la enzima pierde capacidad catalítica.
10.- Aclare el significado de A, B, C y D en el esquema adjunto.
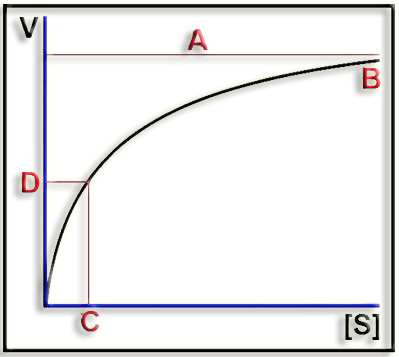
En la mayoría de las reacciones enzimáticas, la velocidad inicial va aumentando en función de la concentración de sustrato, hasta aproximarse de manera asintótica a un valor máximo. Se observa que, en la llamada “zona de saturación”, el incremento de V es apenas significativo por mucho que aumente [S].
A = velocidad máxima.
B = zona de saturación
C = constante de Michaelis-Menten (KM), es decir, la concentración de sustrato que se corresponde con la mitad de la velocidad máxima (D).
11.- En un libro de 2º de Bachillerato figura la siguiente representación de Lineweaver-Burk. ¿Cuál es su significado?
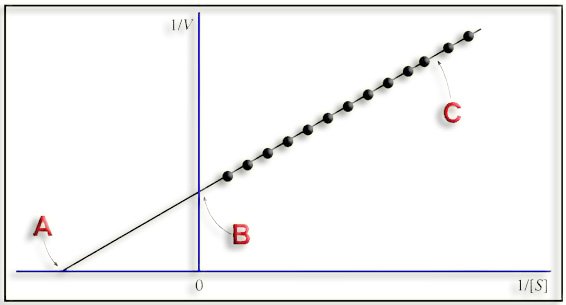
Se trata de una representación gráfica lineal obtenida a partir de la ecuación de Michaelis-Menten, representando en los ejes de coordenadas los inversos de la velocidad y de la concentración de sustrato.
A = abscisa en el origen = -1/ KM
B = ordenada en el origen = 1/ V máxima
C = pendiente de la recta = KM / V máxima
La representación de Lineweaver-Burk permite que, a partir de los datos experimentales, se puedan calcular gráficamente los valores de KM y velocidad máxima de una enzima.
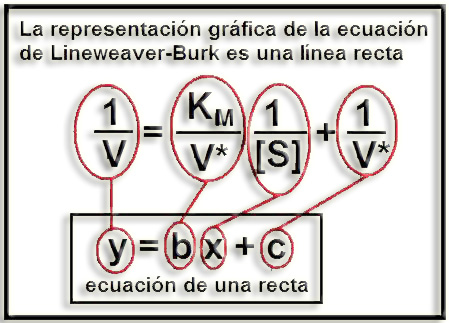
12.- A partir de la ecuación de Michaelis-Menten deduzca la de Lineweaver-Burk.
Ecuación de Michaelis-Menten:
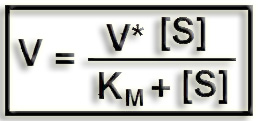
V = velocidad inicial de la reacción
V* = velocidad máxima
[S] = concentración de sustrato libre
KM = constante de Michaelis-Menten
Para obtener la ecuación de Lineweaver-Burk hay que expresar los inversos en ambos miembros de la igualdad anterior y, posteriormente, separar las variables según la ecuación de una línea recta (por ejemplo, y = bx + c). O sea:
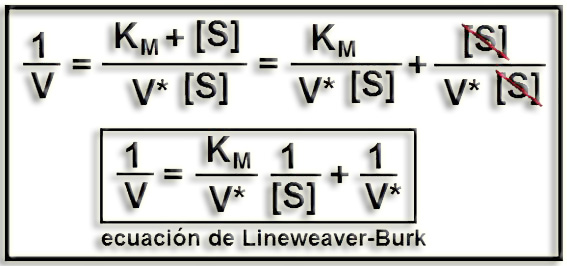
13.- Interprete la gráfica adjunta considerando que se ha representado la cinética de una enzima sin inhibidor y con inhibidor (aclare el significado de las letras A, B, C, d, e).
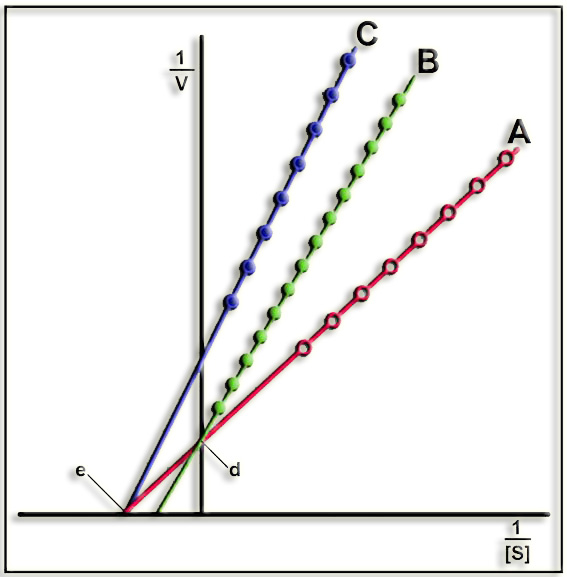
En la representación de Lineweaver-Burk los puntos de cruce con los ejes de coordenadas son:
Ordenada en el origen (d) = 1 / Vmáx.
Abscisa en el origen (e) = -1 / KM
Representaciones gráficas:
A = no existe inhibidor
B = con inhibidor competitivo. En la inhibición competitiva existe la misma V máxima y mayor KM, por lo que el punto de corte con el eje de abscisas (-1/KM) se acerca al origen.
C = con inhibidor no competitivo. En este caso existe la misma KM pero menor V máxima, por lo que el inverso (1/ Vmax) se aleja del origen.
14.- Interprete el gráfico adjunto (aclarando el significado de las letras: A, B, c, d).
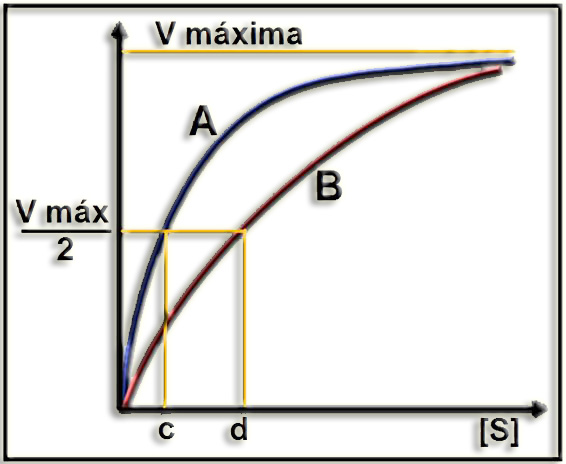
Las enzimas que siguen la cinética de Michaelis, en presencia de inhibidor competitivo, tienen la misma velocidad máxima y diferente KM. Esta inhibición puede superarse aumentando la concentración de sustrato.
A = sin inhibidor
c = constante de Michaelis-Menten (KM)
B = con inhibidor competitivo
d = KM “aparente”
15.- Interprete el gráfico adjunto (aclarando el significado de los números y de las letras minúsculas).
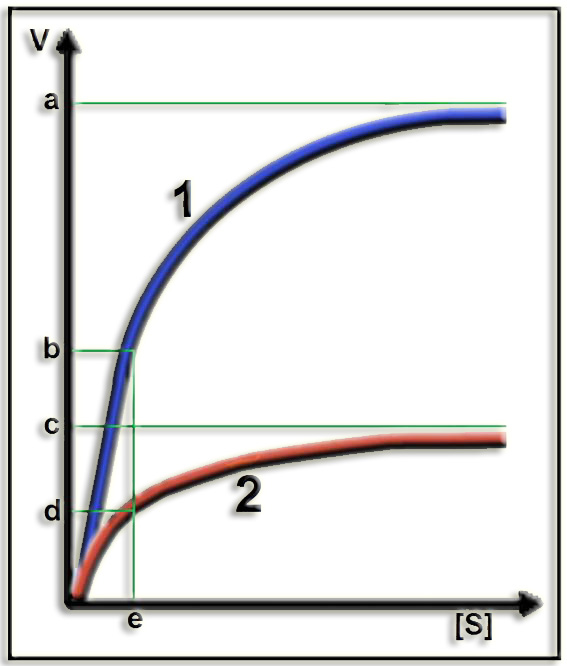
Las enzimas que siguen la cinética de Michaelis, en presencia de inhibidor no competitivo, tienen la misma KM puesto que el sustrato mantiene su capacidad de unión a la enzima, pero diferente velocidad máxima ya que la enzima pierde capacidad catalítica. Esta inhibición no puede superarse aumentando la concentración de sustrato.
1 = sin inhibidor
(a) = Velocidad máxima
(b) = 1 / 2 de V máxima
2 = con inhibidor
(c) = V máxima aparente (Vmap)
(d) = Vmap / 2
(e) = KM
16.- Interprete el esquema adjunto e indique el significado de P.
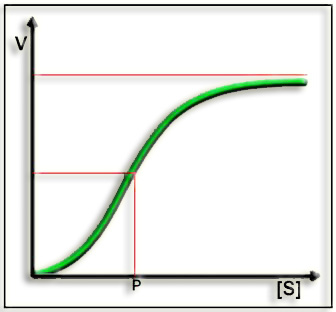
Se trata de la gráfica característica de la cinética sigmoidea (forma de S) propia de las enzimas alostéricas, obtenida al representar la velocidad inicial frente a la concentración de sustrato.
La mayoría de las enzimas alostéricas se encuentran al inicio o en las ramificaciones de las rutas metabólicas. El alosterismo es una de las principales formas de regulación en la célula debido a que puede producir cambios rápidos y fácilmente reversibles en la actividad de las enzimas.
El punto P representa la concentración de sustrato que se corresponde con la mitad de la velocidad máxima, que se designa como K0,5 (para distinguirla de la KM empleada en la cinética de Michaelis o hiperbólica).
17.- Interprete el esquema siguiente (suponga que la velocidad máxima es la misma en los tres casos).
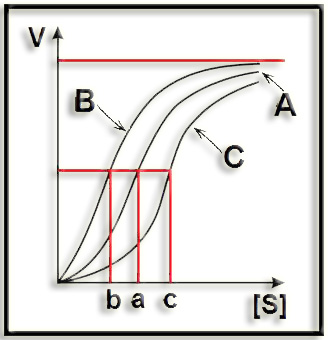
Se trata de curvas sigmoideas, propias de la cinética de una enzima alostérica. Se ha representado la velocidad de reacción en función de la concentración de sustrato, en tres casos:
A = con sustrato solo (a = K0,5).
B = con modulador positivo (b = K0,5).
C = con modulador negativo (c = K0,5).
Se observa que el modulador altera la K0,5 pero no la velocidad máxima.




