Glúcidos 1 (soluciones)
1.- ¿Qué son glúcidos?
Son biomoléculas formadas principalmente por carbono, hidrógeno y oxígeno, en la proporción 1:2:1 (o muy similar). Ejemplos: ribosa (C5H10O5), glucosa (C6H12O6), sacarosa (C12H22O11).
También son llamados carbohidratos o hidratos de carbono, denominación inspirada en la fórmula molecular de muchos de ellos, al estar el H y el O en la misma proporción que en el agua, pero tal denominación es equívoca, pues sugiere que los átomos de carbono van unidos a moléculas de agua, disposición que, estructuralmente, brilla por su ausencia.
Además de glúcidos (término que alude al sabor dulce), a veces se emplea el término sacáridos (del latín saccharum, azúcar), debido al característico sabor de algunos de ellos.
Los glúcidos son las moléculas orgánicas más abundantes de la naturaleza, por ejemplo, la glucosa, el almidón y la celulosa.
2.- Clasificación de los glúcidos.
Los glúcidos se pueden clasificar en dos grandes grupos: osas y ósidos.
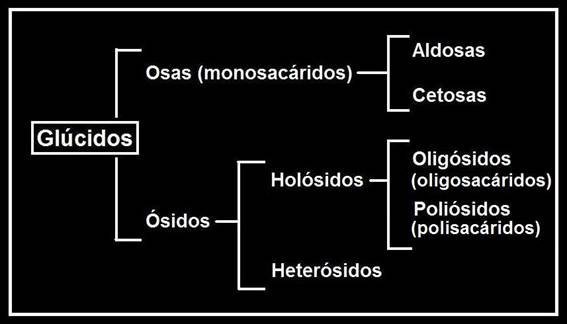
• Las osas o monosacáridos, también llamados azúcares simples, son moléculas pequeñas (en general, de 3 a 7 carbonos). Si llevan la función aldehído se llaman aldosas, y si es la cetónica, cetosas.
• Los ósidos son cadenas moleculares más o menos largas formadas por la unión de osas. Los ósidos pueden ser de dos clases, holósidos y heterósidos.
· Los holósidos son cadenas formadas exclusivamente por osas. Si son cortas, es decir, constituidas por la unión de 2 a 20 osas, las cadenas se llaman oligósidos u oligosacáridos, y si son más largas, poliósidos o polisacáridos.
· Los heterósidos, por ejemplo, glucolípidos y glucoproteínas, resultan al combinarse los glúcidos con diversos componentes no glucídicos (que se llaman, en general, agluconas).
De manera simplificada, pueden considerarse tres grupos:
• Monosacáridos u osas (son las unidades estructurales).
• Oligosacáridos (cadenas formadas por la unión de 2 a 20 osas).
• Polisacáridos (cadenas formadas por más de 20 osas).
Nota.- En otros libros:
Oligosacáridos, cadenas formadas por la unión de 2 a 10 osas.
Polisacáridos, cadenas formadas por más de 10 osas.
3.- ¿Qué funciones biológicas desempeñan los glúcidos?
• Los monosacáridos son muy importantes en las funciones metabólicas. Las triosas fosfato son cruciales en el metabolismo intermediario. La ribulosa difosfato es imprescindible para la fijación del dióxido de carbono en la fotosíntesis. La ribosa forma parte de coenzimas (NAD) y del ARN, y la desoxirribosa, del ADN.
• Algunos polisacáridos tienen utilidad como materiales estructurales. La celulosa, que forma parte de la pared celular de las células vegetales, es la biomolécula orgánica más abundante de la Biosfera. La quitina integra la pared celular de los hongos y el exoesqueleto de los artrópodos. En la pared celular bacteriana hay largas cadenas de polisacáridos entrelazadas con oligopéptidos. Las matrices extracelulares de los tejidos animales de sostén (conjuntivo, óseo, cartilaginoso) están constituidas por polisacáridos nitrogenados.
• Otros polisacáridos son usados como reserva energética de movilización rápida: el glucógeno de los animales y el almidón de los vegetales son polímeros integrados por miles de glucosas. La oxidación de 1 g de glúcido produce 4 kcal.
• También es muy importante la función de señalización puesto que algunos glúcidos pueden unirse a lípidos o a proteínas de la superficie de la célula. Tanto las glucoproteínas como los glucolípidos del exterior celular sirven como señales de reconocimiento para hormonas, anticuerpos, metabolitos, etc. En otros casos las proteínas se unen a una o varias cadenas de oligosacáridos, que sirven como marcador para dirigirlas a su destino dentro de la célula o para ser secretada.
• Por último hay que considerar el aspecto relacionado con la detoxificación. Los organismos deben eliminar ciertos compuestos que son muy poco solubles en agua y cuya acumulación tendría carácter tóxico. Una forma de hacerlo es conjugarlos con un derivado de la glucosa, el ácido glucurónico, para que sean más solubles en agua y así eliminarlos con mayor facilidad. Por ejemplo, la bilirrubina que se forma durante la degradación del grupo hemo de la hemoglobina, en el hígado se combina con ácido glucurónico y de esta forma se puede eliminar a través de la bilis (heces) o de la orina.
4.- Defina monosacárido. ¿Cómo se nombran?
• Los monosacáridos son aldehídos o cetonas polihidroxilados. Si está presente la función aldehído se llaman aldosas, y si llevan la cetónica, cetosas.
Como mínimo presentan tres carbonos y como máximo, en general, siete u ocho. Considerando el número de átomos de carbono constituyentes, pueden ser triosas (3 C), tetrosas (4 C), pentosas (5 C), hexosas (6 C), etc.
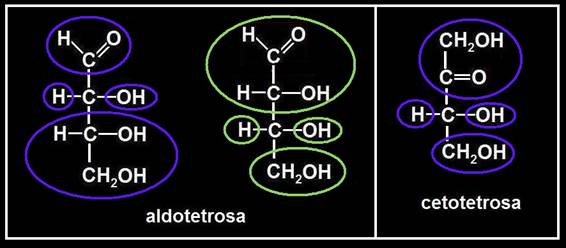
• Genéricamente se nombran según el grupo funcional (“aldo”, “ceto”), el número de carbonos (tri, tetra, penta, etc.) y la terminación “osa”. Ejemplos: aldotriosa, cetotetrosa, cetopentosa, aldohexosa, etc.
Conviene precisar que cada monosacárido tiene su propio nombre específico. Ejemplos: gliceraldehído (aldotriosa), dihidroxiacetona (cetotriosa), eritrosa y treosa (aldotetrosas), ribosa (aldopentosa), ribulosa (cetopentosa), glucosa y galactosa (aldohexosas), fructosa y sorbosa (cetohexosas), etc.
5.- ¿Cuál es el glúcido más pequeño que existe?
El monosacárido u osa de menor masa molecular tiene necesariamente tres carbonos (triosa), dos de ellos con sendos hidroxilos (-OH) más otro con el grupo funcional aldehído o cetónico:
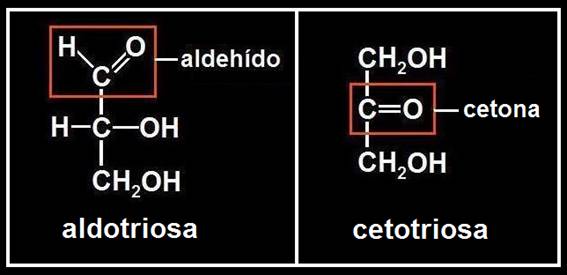
Obsérvese que en ambos casos la fórmula molecular es C3H6O3
6.- Calcule la masa molecular de: triosas, tetrosas, ribosa y glucosa. (Masas atómicas: C = 12 u, H = 1 u, O = 16 u).
La fórmula molecular de los monosacáridos se obtiene dando valores a “n” en la fórmula general: CnH2nOn
• Triosas (n = 3): C3H6O3
• Tetrosas (n = 4): C4H8O4
• Pentosas (n = 5): C5H10 O5
• Hexosas (n = 6): C6H12O6.
• Heptosas (n = 7): C7H14O7
Masas moleculares:
• Triosas. 3x12 u + 6x1 u + 3x16 u = 36 u + 6 u + 48 u = 90 u (unidades de masa atómica)
• Tetrosas. 4x12 u + 8x1 u + 4x16 u = 120 u.
• La ribosa es una pentosa: 5x12 u + 10x1 u + 5x16 u = 150 u.
• La glucosa es una hexosa: 6x12 u + 12x1 u + 6x16 u = 180 u.
Nota.- La masa atómica relativa de un elemento es el número de veces que la masa de un átomo es mayor que la doceava parte de la masa de un átomo de carbono-12.
La masa molecular relativa es el número de veces que la masa de una molécula es mayor que la doceava parte de la masa de un átomo de carbono-12.
7.- Escriba la fórmula desarrollada de una tetrosa.
Es un monosacárido de 4 carbonos, pero como en el enunciado no consta el grupo funcional característico, puede tratarse de una aldotetrosa o una cetotetrosa. El grupo aldehído se representa en la primera posición, y el cetónico, en la segunda:
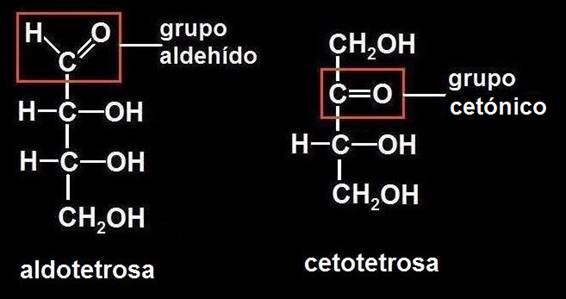
Contando todos los átomos se observa que en ambos casos la fórmula molecular es la propia de las tetrosas: C4H8O4
Nota.- Lo usual es que el grupo alcohólico primario figure en forma semidesarrollada (-CH2OH).
8.- Escriba la fórmula desarrollada de una pentosa.
Este monosacárido tiene 5 carbonos, pero puede tratarse de una aldopentosa o una cetopentosa:
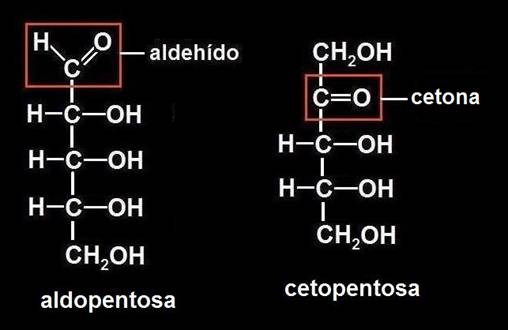
Se observa que en ambos casos la fórmula molecular es C5H10O5
9.- Escriba la fórmula desarrollada de una hexosa.
Las hexosas tienen 6 carbonos, pero puede tratarse de una aldohexosa o una cetohexosa:
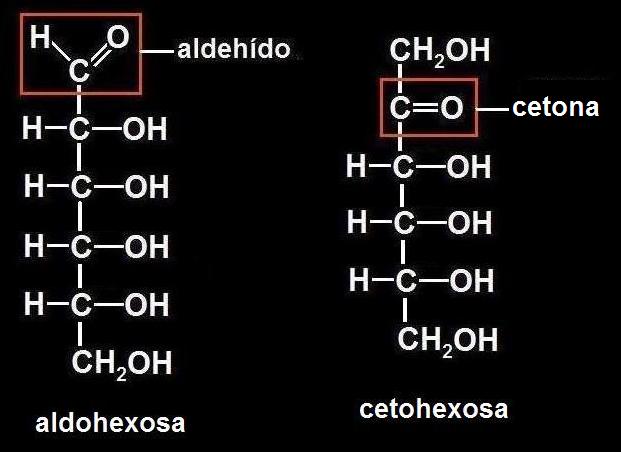
En ambos casos la fórmula molecular es C6H12O6
10.- Representación esquemática de una aldotetrosa.
En ocasiones se evitan las fórmulas desarrolladas y se utilizan representaciones muy simplificadas. Se puede convenir, por ejemplo, en marcar con una circunferencia la posición del grupo aldehído y con un círculo, la del grupo alcohólico primario. Los carbonos intermedios quedan sugeridos mediante unas rayitas orientadas según las posiciones de los grupos OH.
Aplicando lo expuesto al caso de la aldotetrosa resulta lo siguiente:
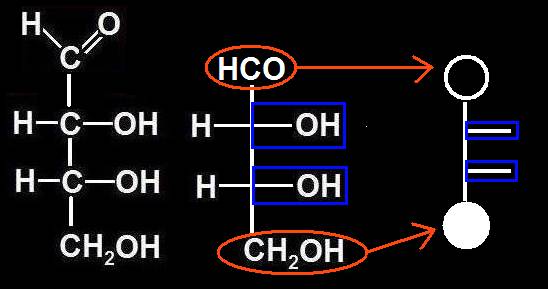
O bien, sin mostrar el paso intermedio del esquema precedente:
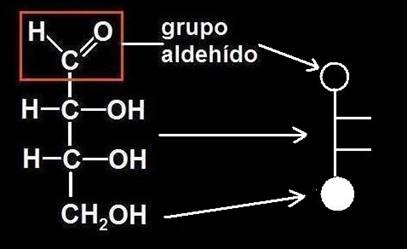
Nota.- El grupo carbonilo (C=O) en posición terminal es propio de los aldehídos (de ahí la denominación “grupo aldehído o aldehídico”).
11.- Escriba la fórmula esquemática de una cetotetrosa.
Se trata de una cetosa con 4 carbonos. En el caso de las cetosas en general, la circunferencia del grupo cetónico ocupa la segunda posición y en cada extremo hay un círculo correspondiente a sendos grupos -CH2OH.
La rayita que se observa en el ejemplo indica que el grupo -OH del carbono número 3 está a la derecha.
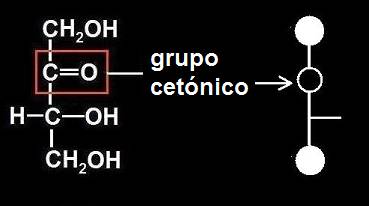
Nota.- El grupo carbonilo (C=O) en posición no terminal es propio de las cetonas (de ahí la denominación “grupo cetónico”).
12.- Represente de manera esquemática tres triosas.
Según la representación simplificada convenida anteriormente:
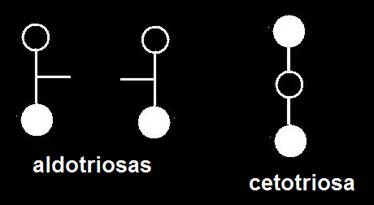
En el caso de las aldotriosas, la rayita que representa el -OH del carbono intermedio puede estar a la derecha o a la izquierda del observador. La cetotriosa sólo admite una única forma.
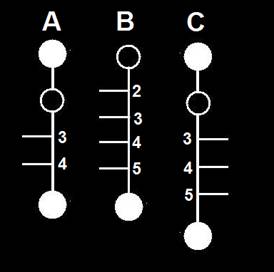
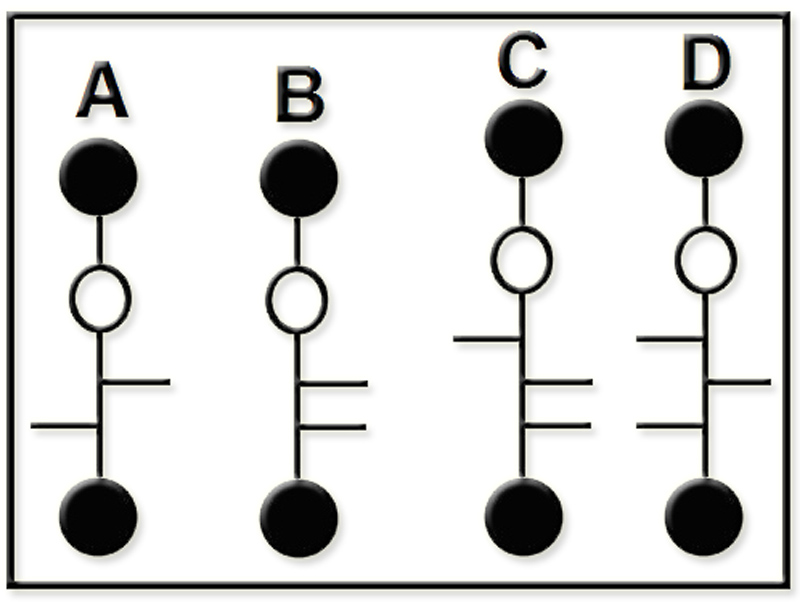
13.- Interprete las siguientes fórmulas esquemáticas y escriba sus nombres genéricos.
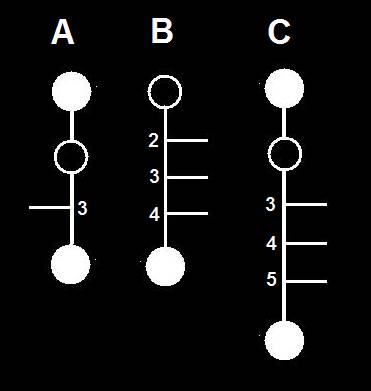
• El esquema A representa una cetotetrosa, con el -OH del carbono 3 hacia la izquierda.
• B corresponde a una aldopentosa, con los -OH de los tres carbonos intermedios (2, 3 y 4) hacia la derecha.
• La fórmula C es propia de una cetohexosa, con los -OH de las posiciones 3, 4 y 5 hacia la derecha.
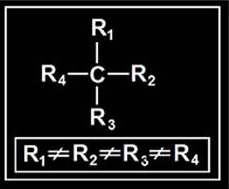
14.- ¿Cuándo se dice que un carbono es asimétrico?
Un carbono es asimétrico cuando está unido a cuatro radicales o sustituyentes diferentes. Espacialmente, los radicales ocuparían los vértices de un tetraedro en cuyo centro estaría el átomo de carbono. Aunque lo usual es la representación plana, debe tenerse en cuenta la disposición tetraédrica:
|
|
|
|
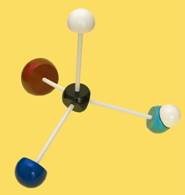
15.- Escriba la fórmula desarrollada del metano. ¿Tiene carbono asimétrico?
El metano carece de C asimétrico al ser los 4 sustituyentes iguales. La figura muestra la fórmula plana y el tetraedro correspondiente.
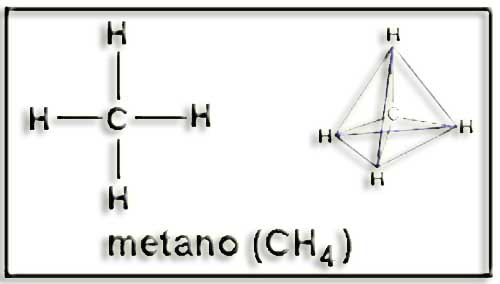
La fotografía del modelo molecular aclara visualmente la disposición tetraédrica (C = negro, H = blanco).

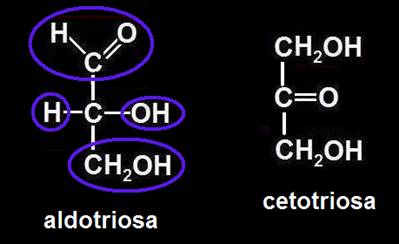
16.- ¿Cuántos carbonos asimétricos tienen las triosas?
Aldotriosa: 1 C asimétrico (el carbono de la posición intermedia está unido a 4 sustituyentes distintos).
Cetotriosa: carece de C asimétrico.
17.- ¿Cuántos carbonos asimétricos tienen las tetrosas?
• Una aldotetrosa tiene dos carbonos asimétricos, que son los intermedios (posiciones 2 y 3). En ambos casos se observa que están unidos a cuatro sustituyentes distintos.
• Una cetotetrosa tiene sólo un C asimétrico, el de la posición 3.
18.- Dadas las siguientes fórmulas esquemáticas, escriba el nombre genérico y numere las posiciones de los carbonos asimétricos.
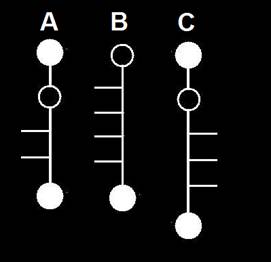
He aquí la solución:
• A = cetopentosa. C3 y C4 son asimétricos.
• B = aldohexosa. C2, C3, C4 y C5 son asimétricos.
• C = cetohexosa. C3, C4 y C5 son asimétricos.
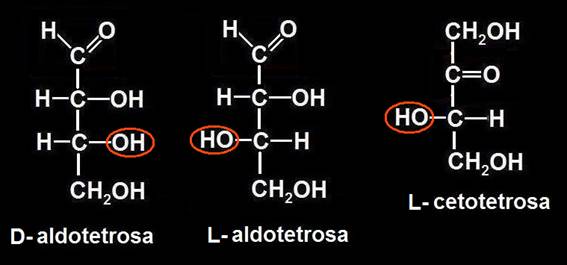
19.- ¿Cuándo se considera que un monosacárido es de la “serie D” o de la “serie L”?
Un monosacárido es de la serie D cuando, estando la molécula convenientemente orientada, el OH del penúltimo carbono queda a la derecha del observador. Es de la serie L cuando dicho grupo OH está a la izquierda.
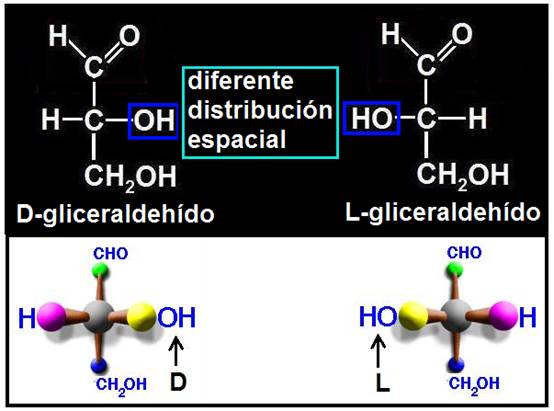
En las aldosas, el grupo aldehído (-CHO) debe estar arriba, y los sustituyentes H y OH del penúltimo carbono, en el plano horizontal, dirigidos hacia el observador. Como las aldotriosas tienen 3 carbonos, la referencia es el OH del carbono intermedio, que es el único asimétrico, resultando: D-gliceraldehído (-OH a la derecha) y L-gliceraldehído (HO- a la izquierda).
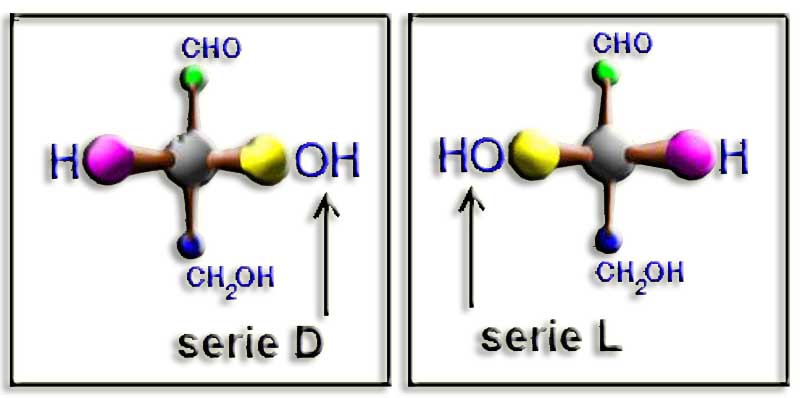
Esto conviene tenerlo siempre presente, pues todas las aldosas restantes se consideran estructuralmente derivadas de las aldotriosas.
En las cetosas, el grupo C=O de la posición 2 debe estar en la mitad superior y los sustituyentes H y OH del penúltimo carbono, dirigidos hacia el observador.
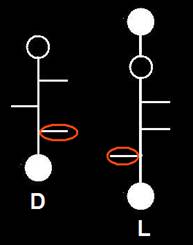
Cuando se utilizan fórmulas planas, se interpreta que el -OH referencial (unido al penúltimo carbono), espacialmente, estaría como en el gliceraldehído.
Si se trata de fórmulas esquemáticas hay que recordar que los grupos -OH de los carbonos asimétricos están representados mediante rayitas, debiendo tomarse como referencia la penúltima posición:
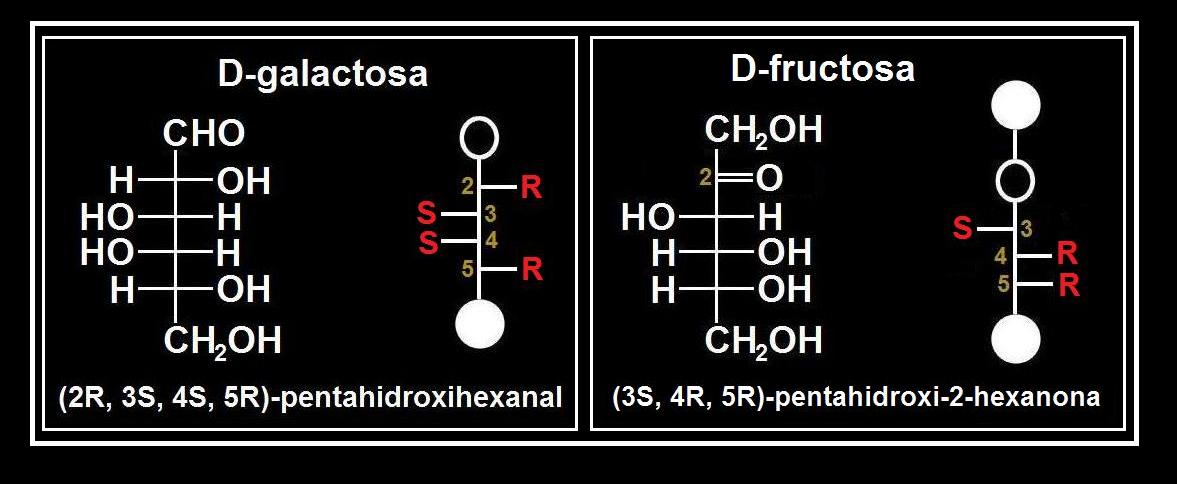
Nota.- Además de la configuración D y L, existe otro sistema menos ambiguo para designar a los estereoisómeros, particularmente a los que poseen dos o más carbonos asimétricos, llamado sistema RS. Consiste en utilizar el nombre químico sistemático del compuesto precisando la posición, derecha (R) o izquierda (S), de los grupos OH unidos a los C asimétricos.
Considerando los dos casos del esquema precedente:
• D-aldopentosa: (2R, 3S, 4R)-tetrahidroxipentanal.
• L-cetohexosa: (3R, 4R, 5S)-pentahidroxi-2-hexanona.
Veamos de manera más detallada este otro par de ejemplos, advirtiendo que en las aldosas no hay que confundir el grupo aldehído (1ª posición: O=C-H, o bien, CHO, COH) con el hidroxilo de las restantes:
20.- Interprete las siguientes fórmulas esquemáticas:
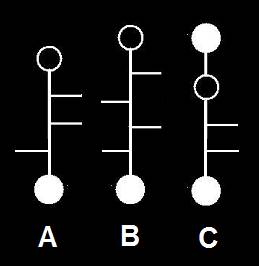
He aquí la solución:
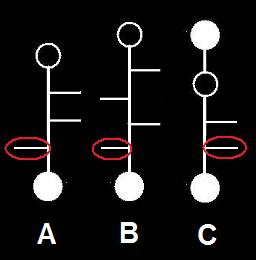
• La fórmula A representa una L-aldopentosa, según el OH referencial (el del penúltimo carbono). Los OH de los carbonos 2 y 3 están a la derecha.
• B corresponde a una L-aldohexosa, con el OH del carbono 3 a la izquierda y los de las posiciones 2 y 4, a la derecha.
• C corresponde a una D-cetopentosa, que tiene en la posición 3 el grupo OH a la derecha.
Nota.- Aplicando el sistema RS, los nombres son los siguientes:
• A = (2R, 3R, 4S)-tetrahidroxipentanal
• B = (2R, 3S, 4R, 5S)-pentahidroxihexanal
• C = (3R, 4R)-tetrahidroxi-2-pentanona
21.- Indique el nombre del siguiente modelo molecular, sabiendo que: C = negro, O = azul y H = blanco.
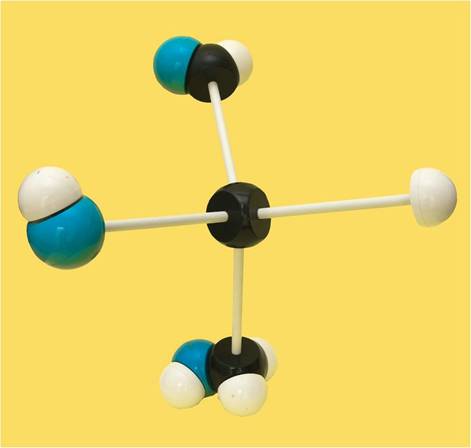
Es una triosa, pues tiene 3 carbonos. El modelo está bien orientado, esto es, con el grupo aldehído arriba, el alcohólico primario abajo, y en el carbono asimétrico, los sustituyentes del plano horizontal están dirigidos hacia el observador, con el OH a la izquierda.
Conclusión: es una aldotriosa de la serie L, concretamente, L-gliceraldehído.
22.- Consulte su libro e indique el nombre específico del modelo molecular adjunto. Clave de colores: rojo = grupo alcohólico primario, negro = C, azul = O, blanco = H.
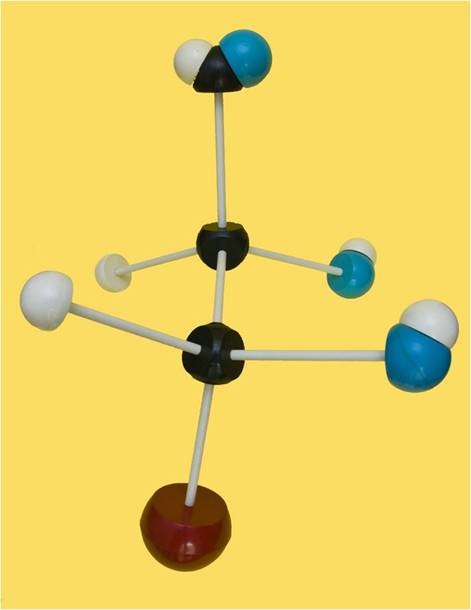
El modelo está bien orientado, esto es, con el grupo aldehído en la parte superior, el alcohólico primario (bola roja) en la inferior, y los sustituyentes referenciales del penúltimo carbono, dirigidos hacia el observador, con el OH a la derecha.
Conclusión: se trata de una aldotetrosa de la serie D. El grupo -OH de la posición 2 (en el mismo lado que el de la 3), indica que es la D-eritrosa.
23.- Consulte su libro e indique el nombre del siguiente modelo molecular. Clave de colores: rojo = grupo alcohólico primario, negro = C, azul = O, blanco = H.
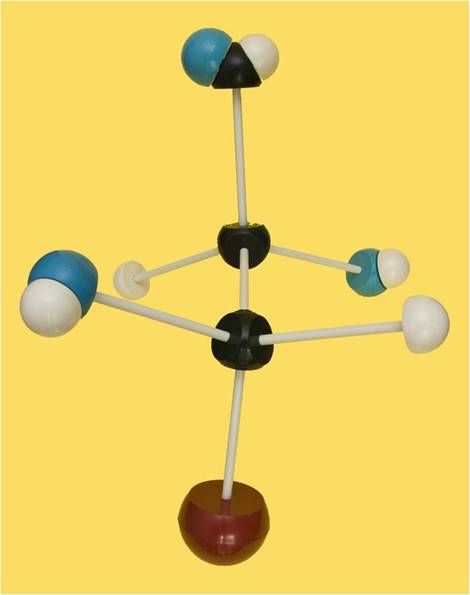
El modelo está bien orientado. Es una aldotetrosa de la serie L, ya que el -OH referencial está a la izquierda del observador. Por las posiciones relativas de los grupos hidroxilo (-OH), se trata de la L-treosa.
24.- ¿Qué son isómeros? Ponga ejemplos con las triosas.
• Dos o más compuestos son isómeros cuando sus moléculas están formadas por el mismo número y clase de átomos, pero agrupados de distinta forma. Dicho de otro modo: son compuestos con la misma fórmula molecular pero con diferente fórmula estructural.
• Las triosas tienen como fórmula molecular C3H6O3. En la llamada isomería de función, las moléculas presentan distinto grupo funcional. Por ejemplo, el gliceraldehído y la dihidroxiacetona:
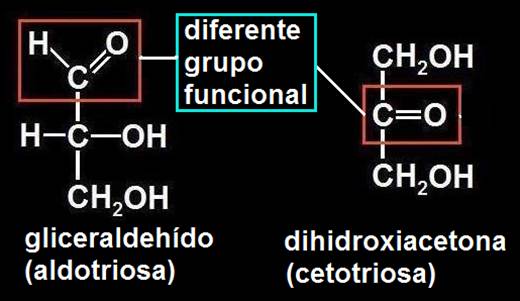
En el caso de las aldotriosas ambas tienen, necesariamente, el mismo grupo funcional (aldehído), pero sus átomos están unidos entre sí de manera diferente, pues en el D-gliceraldehído el -OH del carbono asimétrico está a la derecha, y en el L-gliceraldehído, a la izquierda. Estos dos compuestos son imágenes especulares (como una mano frente al espejo) y reciben la denominación de enantiómeros o enantiomorfos.
25. ¿Qué son estereoisómeros?
Los isómeros espaciales o estereoisómeros son aquellos que se diferencian en la posición relativa de los átomos en el espacio. Esto es posible porque el carbono forma enlaces covalentes dirigidos espacialmente (disposición tetraédrica).
He aquí varios modelos moleculares para cuya interpretación hay que tener en cuenta la posición superior del grupo aldehído y el color rojo del grupo alcohólico primario. Además, en cada extremo libre de las “varillas” oscuras habría un OH, y en los de las blancas, H. Se observa que va cambiando la disposición espacial de tales sustituyentes en los carbonos asimétricos. Estos modelos (incompletos por falta de átomos de H y grupos OH) representarían estereoisómeros de las aldopentosas.
|
|
|
|
|
|
|
|
26.- ¿Qué son isómeros ópticos?
Si los estereoisómeros tienen las mismas propiedades químicas y sólo difieren en su actividad óptica (cuya determinación se efectúa en un polarímetro), se llaman isómeros ópticos.
Hay dos tipos de isómeros ópticos. Cuando uno es como la imagen especular de otro, no superponible, se llaman enantiómeros o enantiomorfos. Los isómeros ópticos que no son enantiomorfos se llaman diastereoisómeros.
27.- ¿Qué propiedad característica presentan los enantiómeros?
Los enantiómeros, también llamados enantiomorfos, son moléculas que coinciden en todas sus propiedades excepto en su capacidad de desviar el plano de la luz polarizada cuando están en disolución, razón por la cual se dice que presentan actividad óptica o que poseen poder rotatorio. Esta propiedad se debe a la presencia de uno o más carbonos asimétricos.
Uno de los enantiómeros desvía la luz polarizada hacia la derecha (como las agujas del reloj) y se designa como dextrógiro (+), mientras que el otro, llamado levógiro (-), la desvía en igual magnitud pero hacia la izquierda. El aparato que mide el ángulo de desviación se llama polarímetro.
28.- ¿Son dextrógiros los monosacáridos de la serie D y levógiros los de la serie L?
No tiene nada que ver. Son conceptos diferentes. Por ejemplo, la D-fructosa es levógira.
Tanto la serie D como la L se refieren a la disposición espacial del -OH unido al penúltimo carbono.
Dextrógiro o levógiro son términos referidos a la desviación (derecha o izquierda) del plano de la luz polarizada cuando las disoluciones de los monosacáridos se analizan en el polarímetro.
Aunque la mayoría de las D-osas sean dextrógiras, y levógiras las L-osas, para determinar esta propiedad con certeza y medir el ángulo de desviación es preciso efectuar el correspondiente análisis en el polarímetro.
29.- ¿Puede ser posible que el polarímetro marque “cero” al analizar una disolución de triosa?
Sí, en el caso de la cetotriosa (dihidroxiacetona), pues al no tener ningún carbono asimétrico carece de actividad óptica.
Por otra parte, aunque el gliceraldehído (aldotriosa) es ópticamente activo, también podría ocurrir que la disolución analizada fuera una mezcla equimolecular de los enantiómeros D y L, en cuyo caso el polarímetro marcaría “cero” al anularse por compensación los ángulos de desviación.
30.- ¿Cuántos estereoisómeros tiene un monosacárido? Ponga ejemplos con las fórmulas esquemáticas de las tetrosas y marque las posiciones de los carbonos asimétricos con un asterisco. Indique además los nombres específicos (consulte su libro).
El número de isómeros espaciales o estereoisómeros viene dado por la fórmula 2n, siendo n el
número de carbonos asimétricos. Una mitad de ellos son de la serie D y la otra, de la L.
Las aldotetrosas poseen 2 carbonos asimétricos (*), resultando cuatro isómeros (22 = 4).
Los llamados enantiómeros son imágenes especulares, por ejemplo, la D-eritrosa y la L-eritrosa.
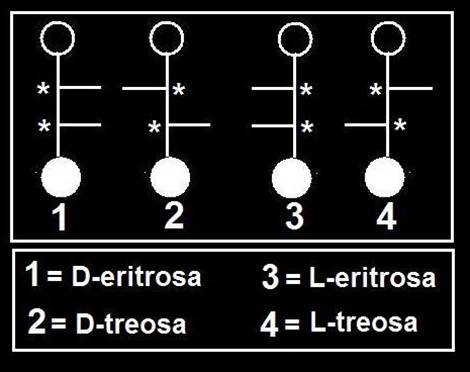
Las cetotetrosas tienen un único carbono asimétrico (*), por lo que resultan dos isómeros, que al ser imágenes especulares reciben la denominación especial de enantiómeros.
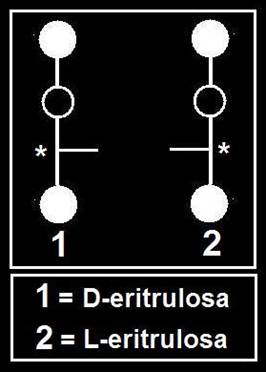
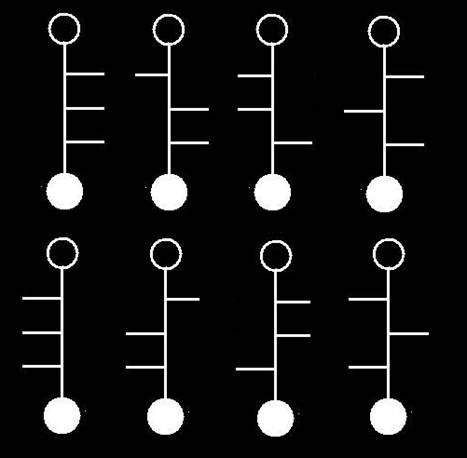
31.- ¿Cuántos estereoisómeros tienen las pentosas? Represente sus fórmulas esquemáticas.
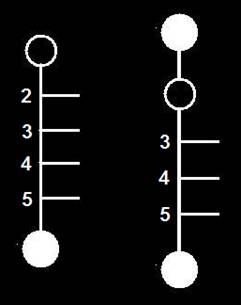
Las aldopentosas tienen tres carbonos asimétricos (posiciones 2, 3 y 4), por lo que resultan ocho isómeros espaciales (23 = 8).
Cuatro de ellos son de la serie D y otros cuatro dela L, como indica la rayita (-OH) de la penúltima posición:
En el caso de las cetopentosas hay dos C asimétricos (posiciones 3 y 4). Por lo tanto hay cuatro isómeros (22 = 4), dos de la serie D y otros dos de la L:
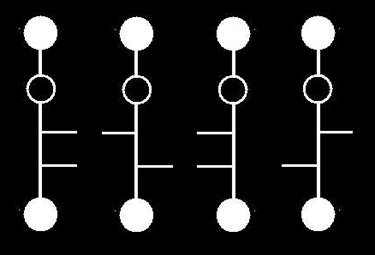
32.- ¿Cuántos estereoisómeros tienen las hexosas?
• Las aldohexosas tienen cuatro carbonos asimétricos (posiciones 2, 3, 4 y 5), por lo que resultan 16 isómeros espaciales o estereoisómeros (24).
• En el caso de las cetohexosas hay tres C asimétricos (posiciones 3, 4 y 5). Por lo tanto hay 8 estereoisómeros (23).
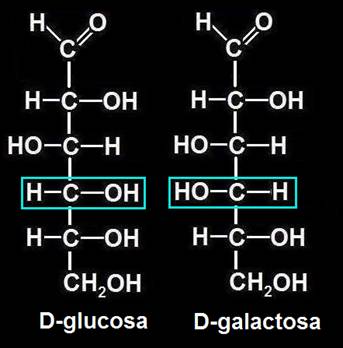
33.- ¿Qué son epímeros? Ponga un ejemplo con fórmulas desarrolladas y las correspondientes esquemáticas.
Son epímeros aquellos estereoisómeros que difieren en la configuración de un único carbono asimétrico. Por ejemplo, la glucosa y la galactosa (aldohexosas) son epímeros con respecto al C 4:
|
|
|
|
34.- Consulte su libro e identifique los dos modelos moleculares adjuntos, según la clave: negro (C), azul (O), blanco (H), rojo (grupo alcohólico primario), varillas oscuras (posiciones de los grupos OH) y varillas blancas (posiciones de los H). Represente las correspondientes fórmulas esquemáticas.

Se trata de dos aldohexosas de la serie D, que son epímeros con respecto al carbono 3.
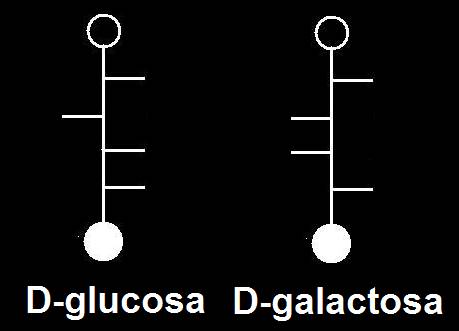
35.- Consulte su libro e identifique los dos modelos moleculares adjuntos, según la clave: negro (C), azul (O), blanco (H), rojo (grupo alcohólico primario), varillas oscuras (posiciones de los grupos OH) y varillas blancas (posiciones de los H). Represente las correspondientes fórmulas esquemáticas.

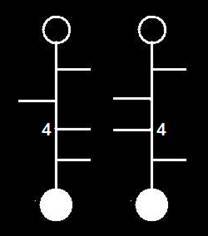
Se trata de dos aldohexosas de la serie D, epímeros con respecto al carbono 4.
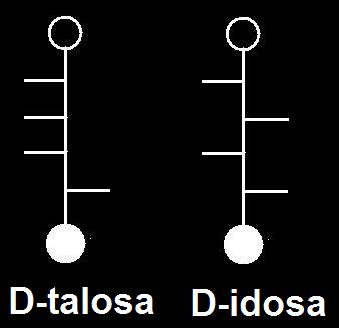
36.- Consulte su libro e identifique los dos modelos moleculares adjuntos, según la clave: negro (C), azul (O), blanco (H), rojo (grupo alcohólico primario), varillas oscuras (posiciones de los grupos OH) y varillas blancas (posiciones de los H). Represente las correspondientes fórmulas esquemáticas.

Se trata de dos aldohexosas de la serie L, epímeros con respecto al C 4.
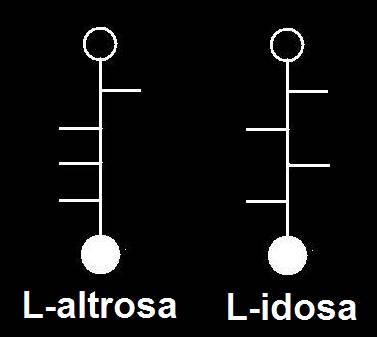
37.- Consulte su libro e identifique los dos modelos moleculares adjuntos, según la clave: negro (C), azul (O), blanco (H), rojo (grupo alcohólico primario), varillas oscuras (posiciones de los grupos OH) y varillas blancas (posiciones de los H). Represente las correspondientes fórmulas esquemáticas.

Se trata de dos aldohexosas de la serie L siendo epímeros con respecto al C 2.
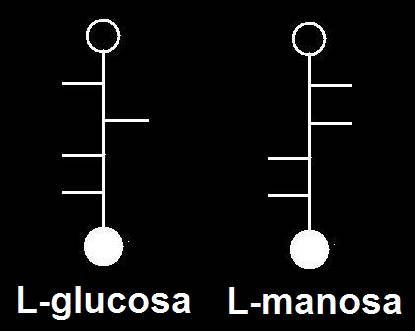
38.- Consulte su libro e identifique los dos modelos moleculares adjuntos, según la clave: negro (C), azul (O), blanco (H), rojo (grupo alcohólico primario). Represente las correspondientes fórmulas esquemáticas.
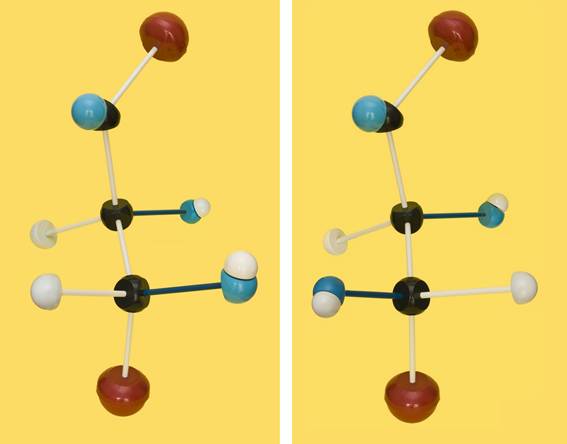
Se trata de dos cetopentosas, una de la serie D y otra de la serie L.
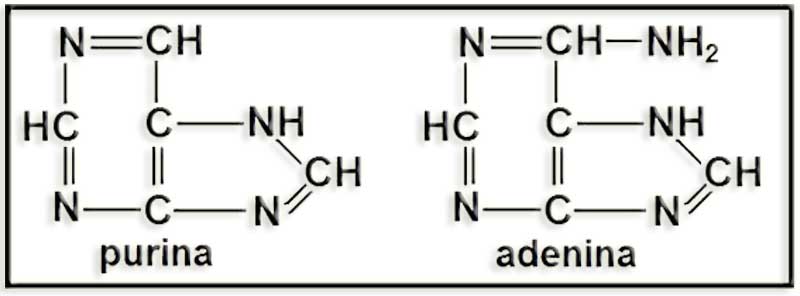
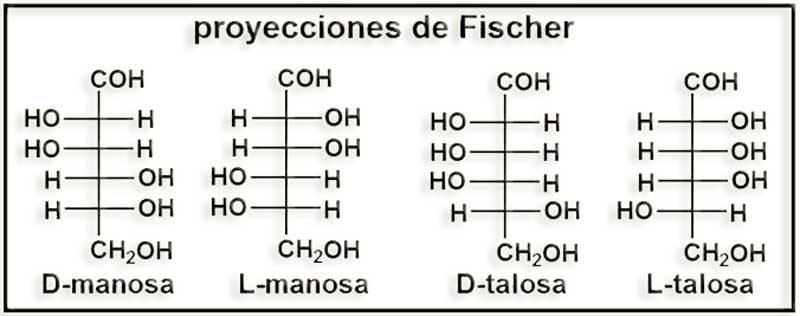
39.- (Internet: “Nobelprize.org”). Busque información sobre el Nobel de Química de 1902 y dé un vistazo a la Nobel Lecture. Escriba en su cuaderno las siguientes fórmulas tal y como aparecen en dicho documento: purina, adenina, D-manosa, L-manosa, D-talosa y L-talosa.
Emil Fischer fue galardonado con el premio Nobel de Química de 1902. En la Nobel Lecture expuso un resumen de sus investigaciones sobre la síntesis de purinas y de azúcares.

Emil Fischer (1852-1919)
Las fórmulas pedidas en el enunciado son las siguientes:
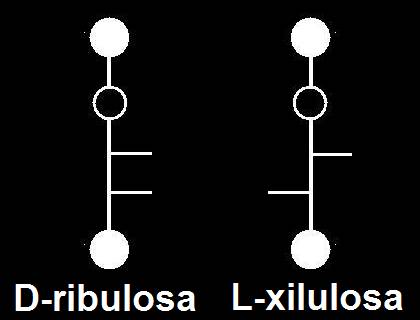
40.- Deducir las proyecciones de Fischer a partir de los esquemas adjuntos. Consulte su libro para asignar los nombres.
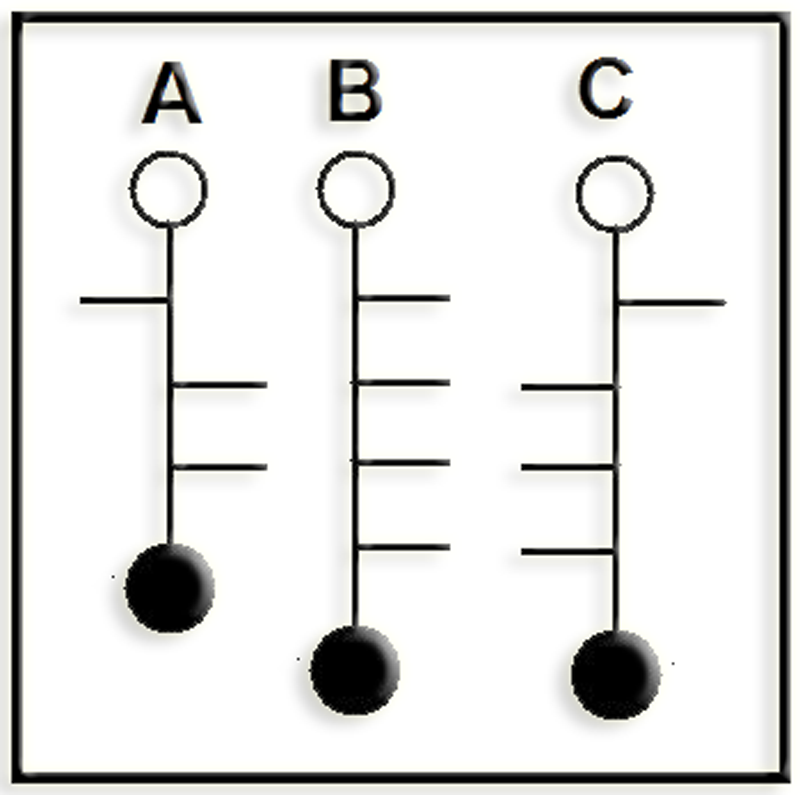
He aquí la solución:
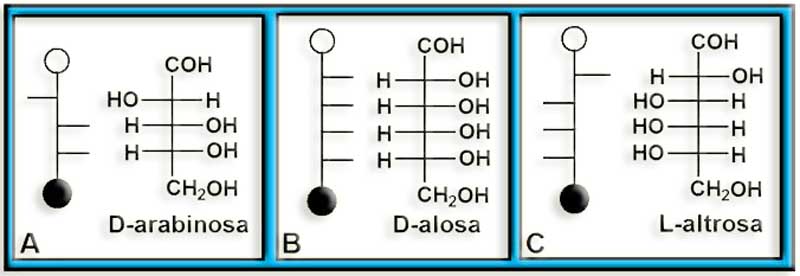
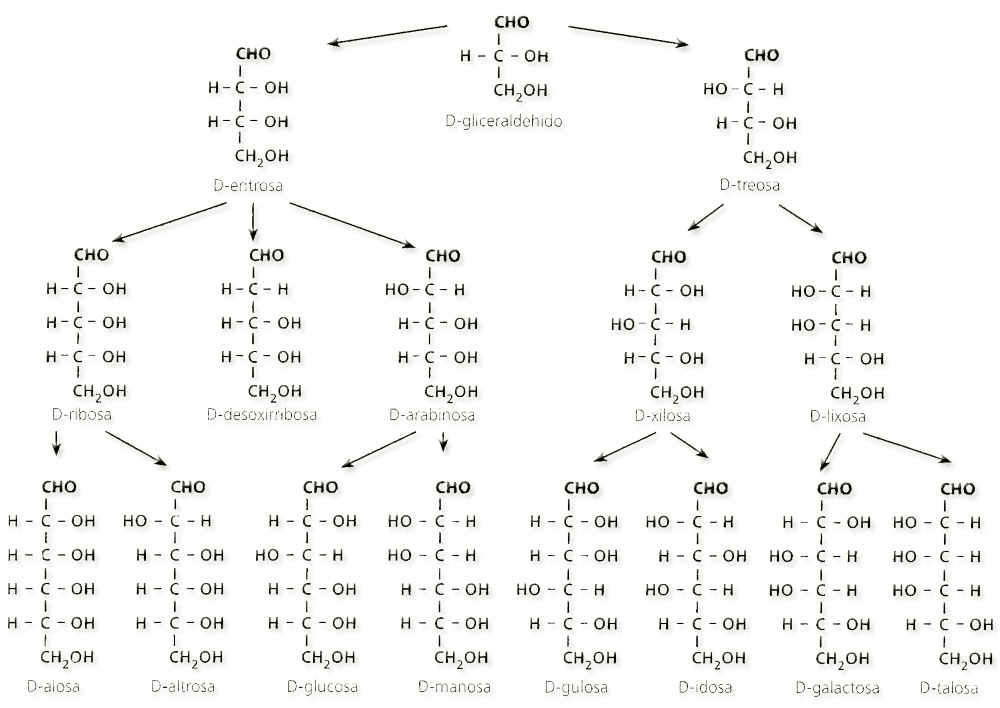
41.- Consulte su libro y copie en su cuaderno las fórmulas de las aldosas (según la proyección de Fischer). Identifique las representaciones esquemáticas adjuntas.
He aquí las fórmulas de las aldosas:
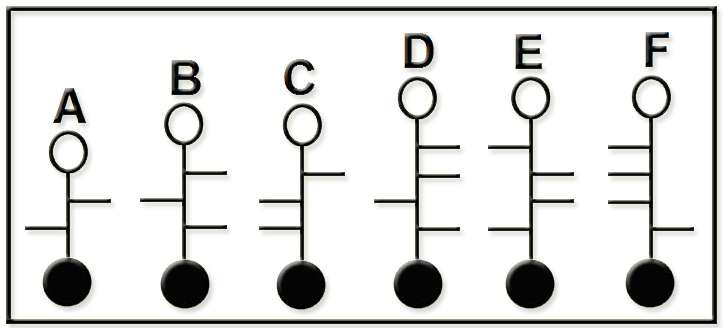
Los nombres de las fórmulas esquemáticas propuestas son:
A = L-treosa. B = D-xilosa. C = L-arabinosa. D = D-gulosa. E = L-galactosa. F = D-talosa.
42.- Consulte su libro y copie en su cuaderno las fórmulas de las cetosas (según la proyección de Fischer). Identifique las representaciones esquemáticas adjuntas.
He aquí las fórmulas de las cetosas (4, 5 y 6 carbonos):
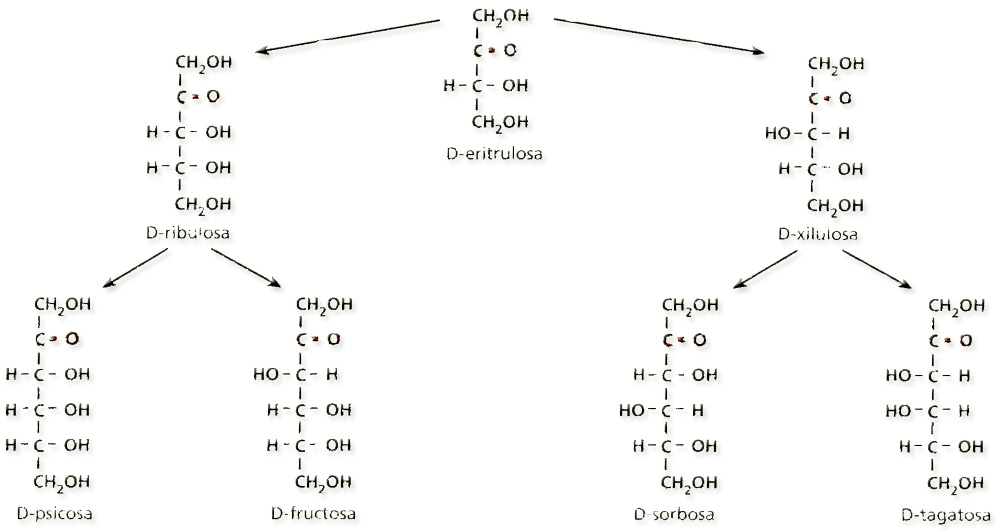
Los nombres de las fórmulas esquemáticas propuestas son:
A = L-xilulosa. B = D-ribulosa. C = D-fructosa. D = L-sorbosa.
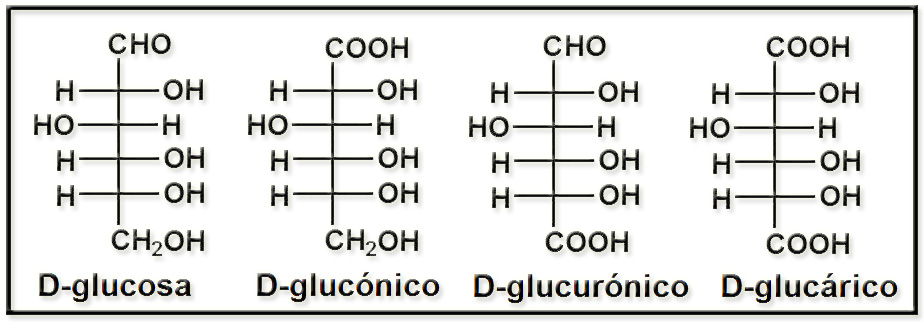
43.- (Consulte su libro). Formular, según la proyección de Fischer, los ácidos glucónico, glucurónico y glucárico.
Los llamados azúcares ácidos se forman por oxidación de las aldosas a ácidos carboxílicos (−COOH), ya sea en el grupo aldehídico, en el alcohólico primario o en ambos. Considerando la D-glucosa:
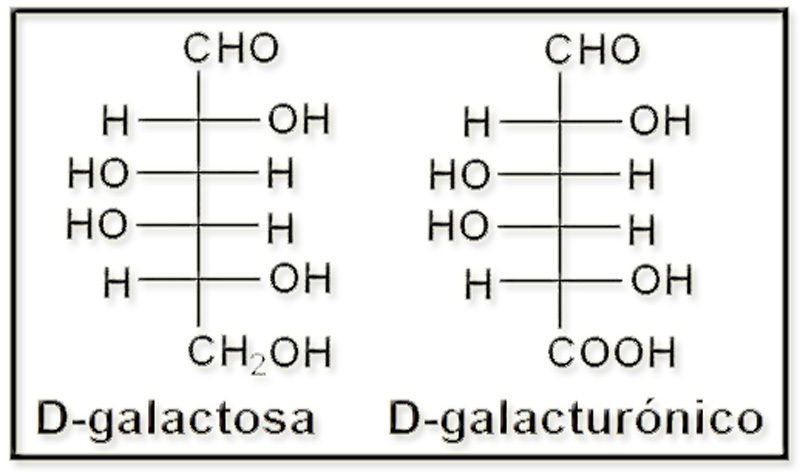
44.- Formular el ácido D-galacturónico (proyección de Fischer).
Este ácido se forma por oxidación del grupo alcohólico primario de la D-galactosa originando un grupo carboxilo:
45.- Exponga una interpretación de las fórmulas adjuntas.
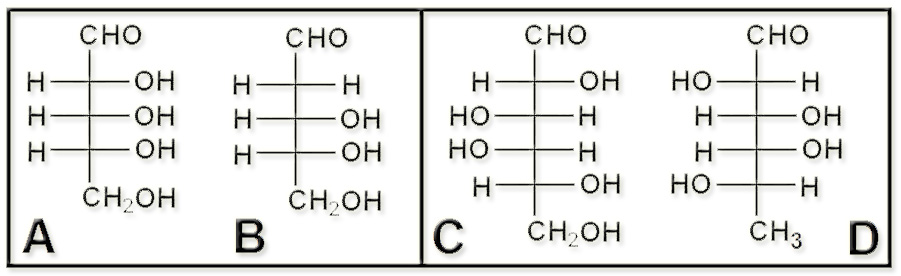
• Los desoxiazúcares se caracterizan por la pérdida de un átomo de oxígeno. Cuando la desoxigenación afecta a un grupo hidroxilo (OH) lo que queda es H.
• La fórmula A es la D-ribosa, una pentosa fácilmente reconocible por sus 3 grupos OH intermedios a la derecha. El nombre de B es D-2-desoxirribosa, observándose que la desoxigenación ha tenido lugar en la posición 2.
• La fórmula C es la D-galactosa. La D deriva de su enantiomorfo y presenta una desoxigenación en el grupo alcohólico primario, por lo que el último carbono queda como −CH3. Su nombre es: L-6-desoxigalactosa.