Glúcidos 2 (soluciones)
1.- ¿Qué es un hemiacetal?
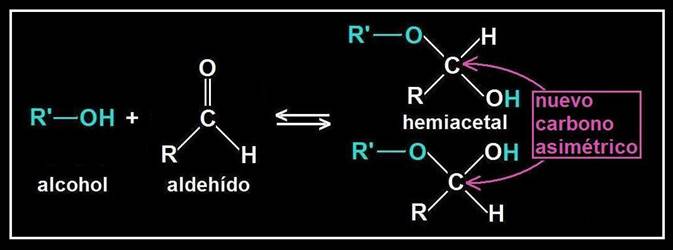
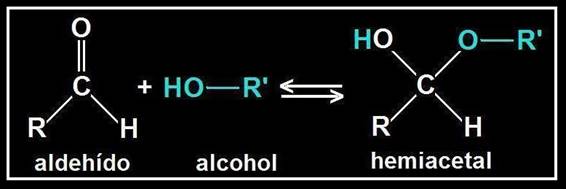
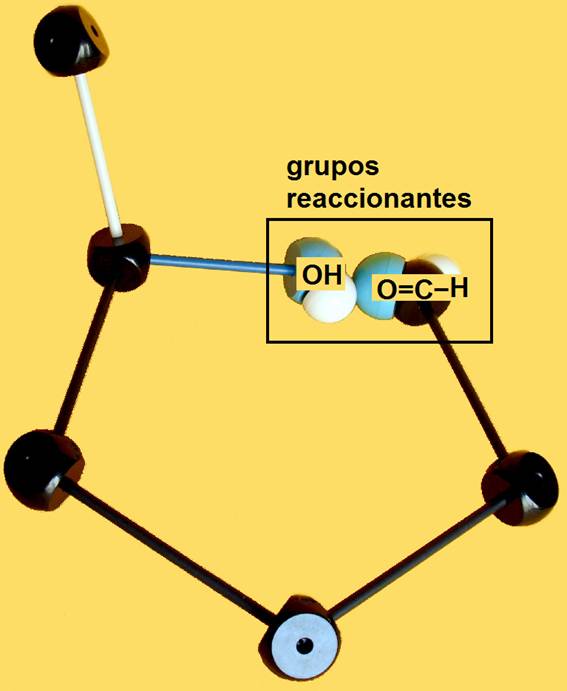
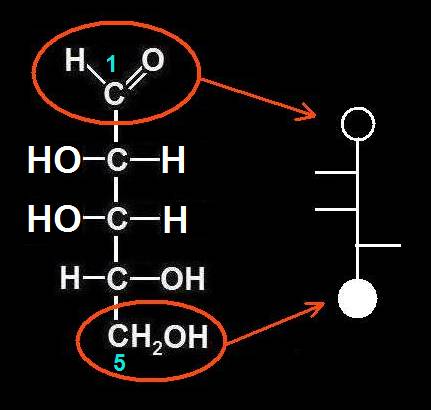
Se llama hemiacetal al compuesto que resulta al reaccionar un grupo hidroxilo (alcohólico) con otro aldehído. El nuevo enlace formado no implica pérdida ni ganancia de átomos, sino una reorganización de los mismos.
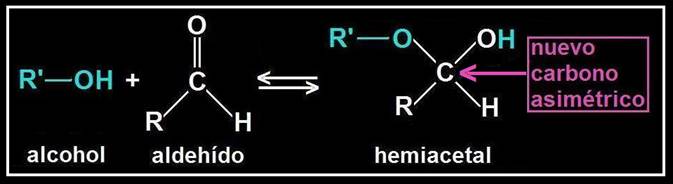
Se origina un carbono asimétrico (ya que los 4 sustituyentes son diferentes), llamado hemiacetálico. Debido a la disposición tetraédrica, el grupo OH de nueva formación puede quedar por encima o por debajo del plano R−C−O−R’.
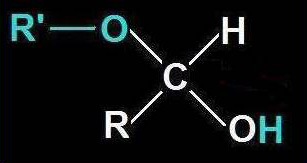
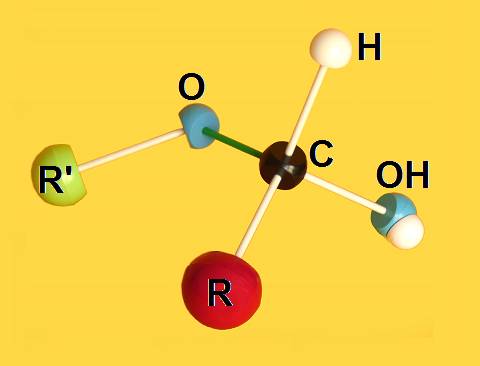
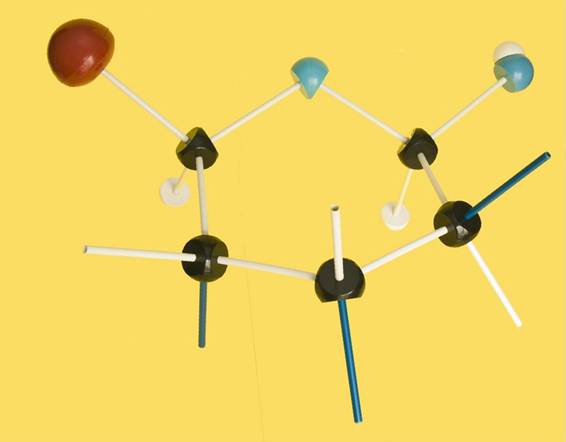
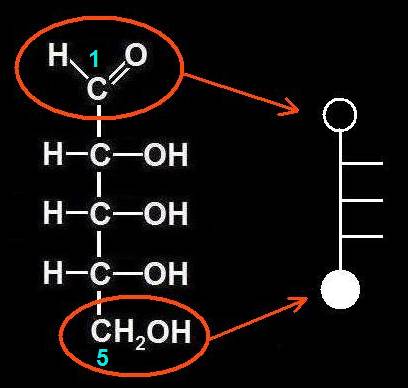
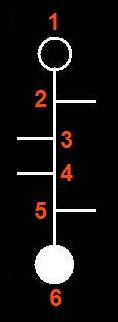
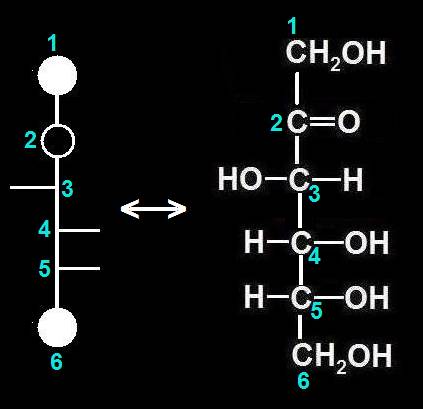
2.- Identifique en el modelo molecular adjunto los átomos o grupos propios del hemiacetal.
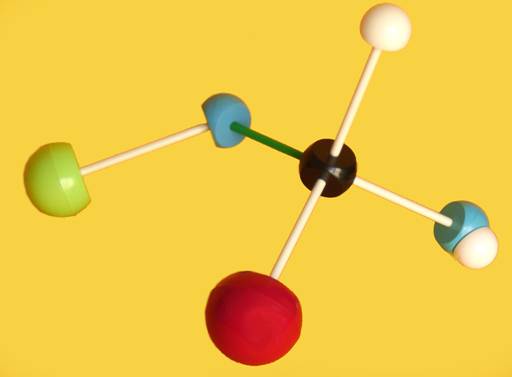
He aquí la solución:
|
|
|
|
3.- Represente la formación de un hemiacetal y voltee o gire para verlo en distintas posiciones.
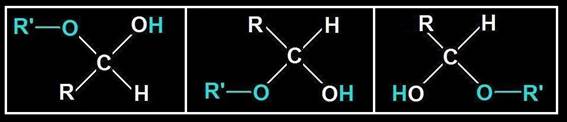
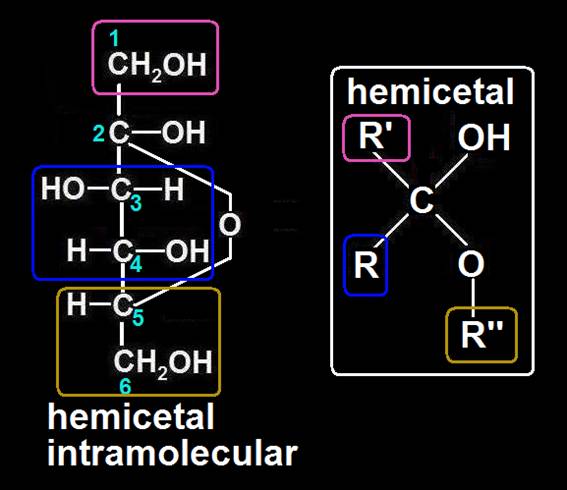
4.- ¿A qué se llama hemiacetal intramolecular?
Cuando los grupos reaccionantes, −OH y −CHO, pertenecen al mismo compuesto se forma un hemiacetal intramolecular, quedando ciclado.
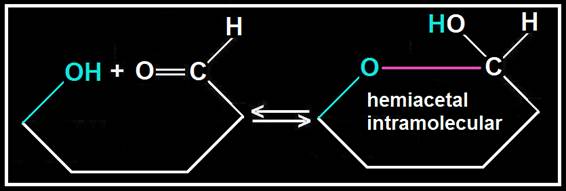
Esto ocurre cuando están en disolución acuosa las aldosas de al menos 5 carbonos, pues los grupos reaccionantes pueden quedar muy próximos al producirse giros entre los carbonos.
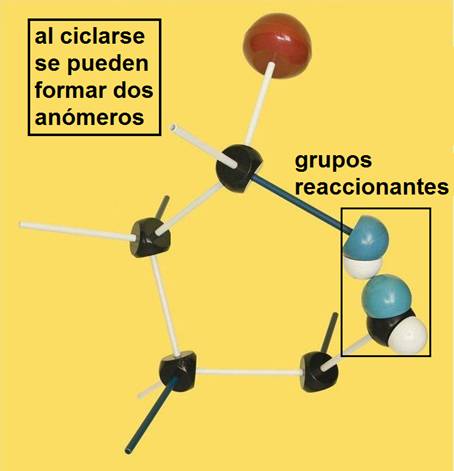
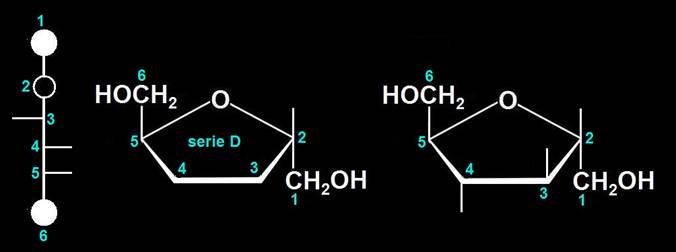
5.- ¿Qué son anómeros?
Son isómeros que se forman en la ciclación molecular de algunos monosacáridos al introducirlos en medio acuoso. Este proceso, llamado anomerización, origina un nuevo carbono asimétrico que lleva unido un grupo hidroxilo (-OH) cuya orientación puede determinar dos anómeros, el α (alfa) y el β (beta). Dicho carbono, llamado anomérico (hemiacetálico), es bastante reactivo y determina las propiedades reductoras, entre otras.
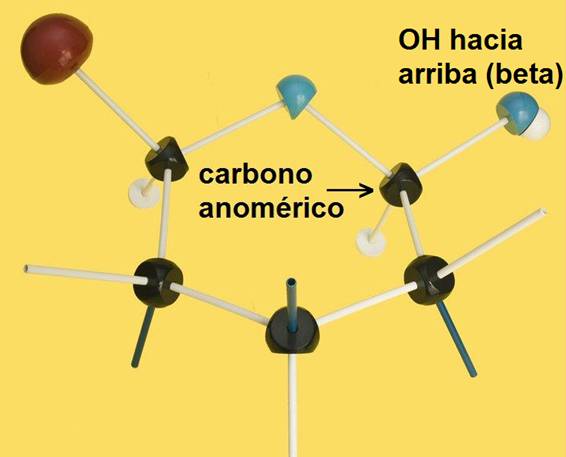
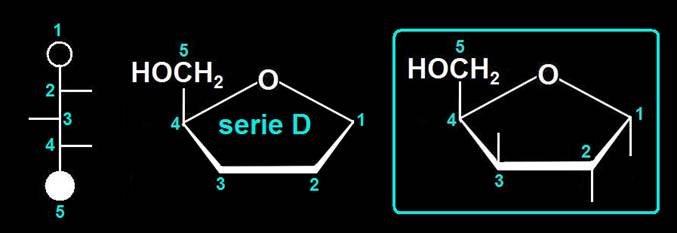
Dada la estructura del átomo de carbono se pueden formar anillos pentagonales o hexagonales. Cuando el monosacárido ciclado es de la serie D, el anómero β es el que muestra el OH de nueva formación por encima del plano del anillo, mientras que en el α queda por debajo.
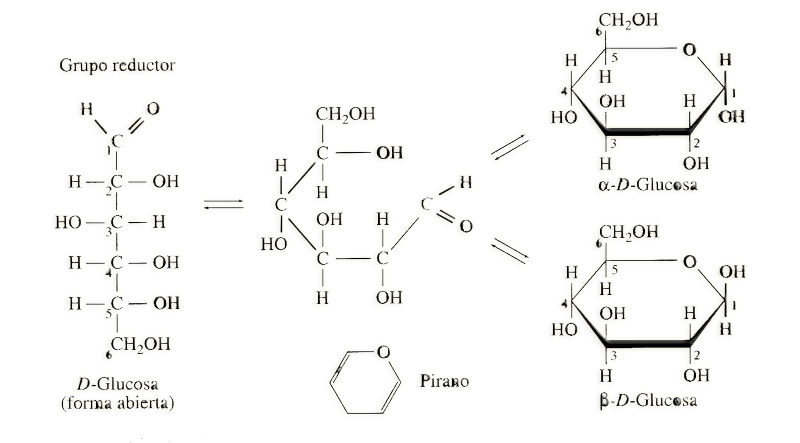
Nota.- En todos los libros de Biología de 2º de Bachillerato hay buenas ilustraciones sobre la ciclación de los monosacáridos. Por ejemplo:
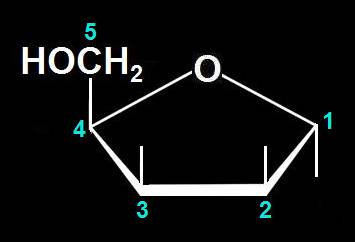
6.- (Consulte su libro). Dado el modelo adjunto, escriba la fórmula omitiendo los carbonos del polígono (numerados), según la clave: rojo (grupo alcohólico primario), negro (C), azul (O), blanco (H), varillas oscuras y blancas (OH y H, respectivamente).
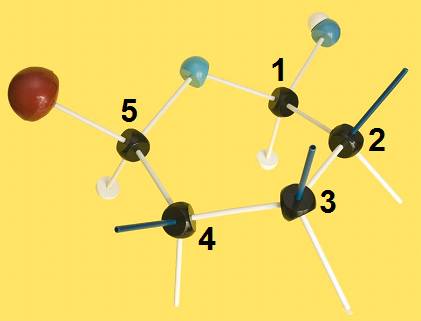
Se observa que todos los OH están por encima del plano hexagonal definido por el oxígeno y cinco carbonos, o sea: O-C1-C2-C3-C4-C5-O.
Con las consideraciones del enunciado resulta:
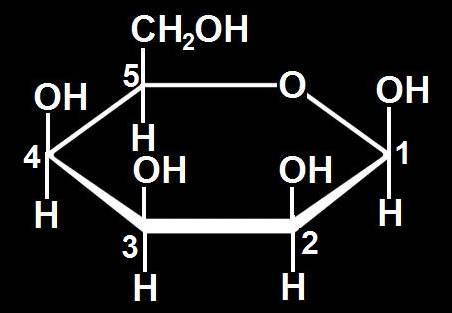
Contando todos los átomos se obtiene la fórmula molecular propia de las hexosas: C6H12O6.
Nota.- Se suele resaltar la parte delantera del polígono para sugerir la perpendicularidad con respecto al plano del papel de un libro (o pantalla del ordenador).
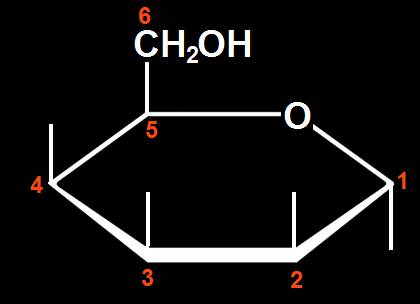
7.- Consulte su libro e interprete el modelo siguiente, según la clave de colores de la pregunta anterior. Haga una representación esquemática, numerando las posiciones de los carbonos (omita los H y señale con rayitas los grupos OH).
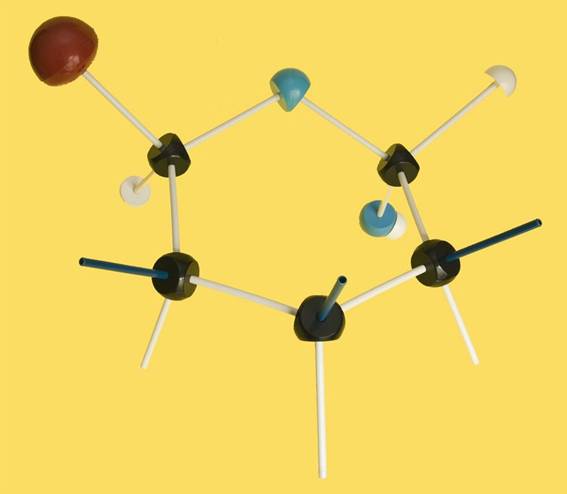
Se trata de una D-aldohexosa ciclada en forma alfa (α), ya que el OH del carbono 1 (anomérico) está por debajo del plano hexagonal. Los 3 OH restantes, señalados con las varillas oscuras, están hacia arriba.
La fórmula esquemática del modelo sería:
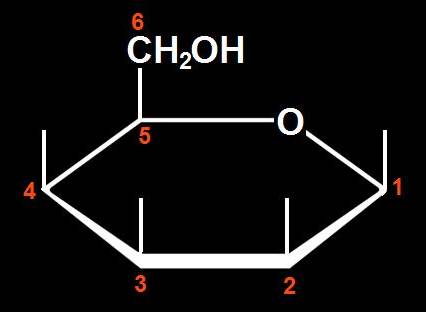
8.- Interprete el modelo adjunto y represente la fórmula esquemática.
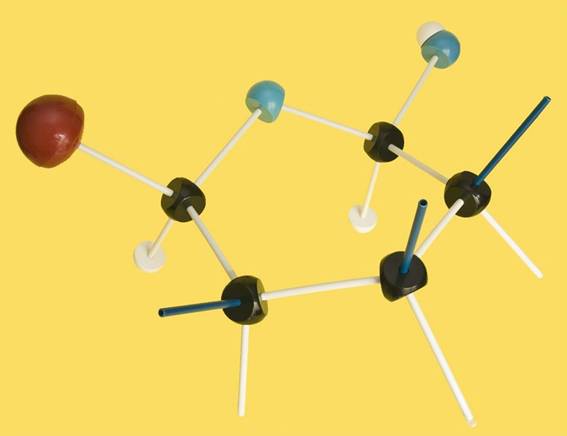
Se trata de una D-aldohexosa ciclada en forma beta, ya que el OH del C anomérico está por encima del plano hexagonal. Los 3 OH restantes, señalados con las varillas oscuras, están hacia arriba.
La fórmula esquemática del modelo sería la siguiente:
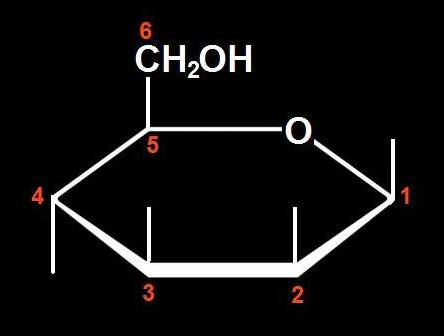
9.- Interprete el modelo adjunto y represente la fórmula esquemática.
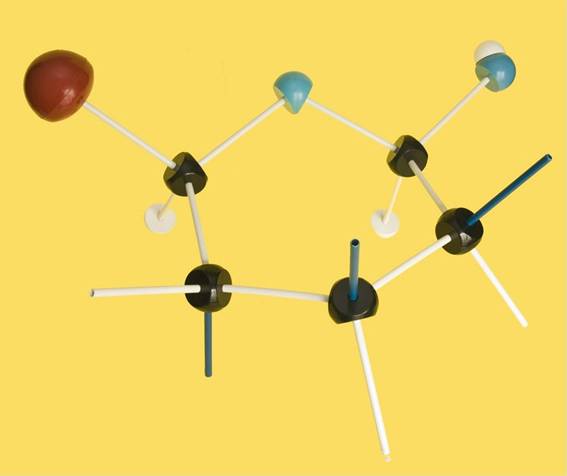
Se trata de una D-aldohexosa ciclada en forma beta, ya que el OH del carbono 1 (anomérico) está por encima del plano hexagonal. Los 2 OH siguientes, señalados con las varillas oscuras, están hacia arriba, pero el OH del C 4 está por abajo.
Por consiguiente, la fórmula esquemática sería así:
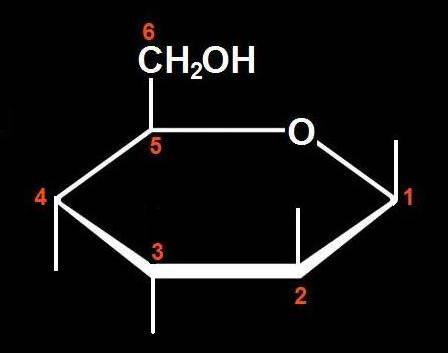
10.- Interprete el modelo adjunto y represente la fórmula esquemática.
Se trata de una D-aldohexosa ciclada en forma beta, ya que el OH del carbono 1 (anomérico) está por encima del plano hexagonal. Las varillas oscuras marcan las posiciones de los OH, estando el del C 2 por arriba y los del C 3 y C 4, por abajo.
Por consiguiente, la fórmula esquemática del modelo sería así:
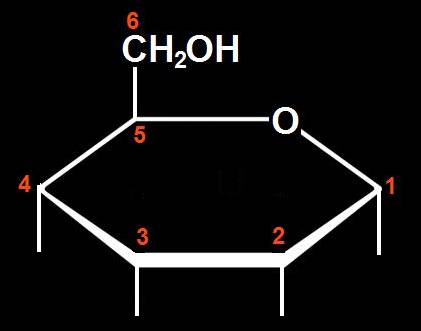
11.- Deduzca la fórmula abierta que se corresponde con el esquema adjunto. Justifique la respuesta.
Se trata de una aldohexosa de la serie D. Al abrirse el ciclo, el grupo aldehído quedaría en la 1ª posición y el alcohólico primario, en la 6ª. Las rayitas de los OH unidos a los carbonos 2, 3 y 4, que están hacia abajo en el ciclo, se sitúan, por convenio, a la derecha:
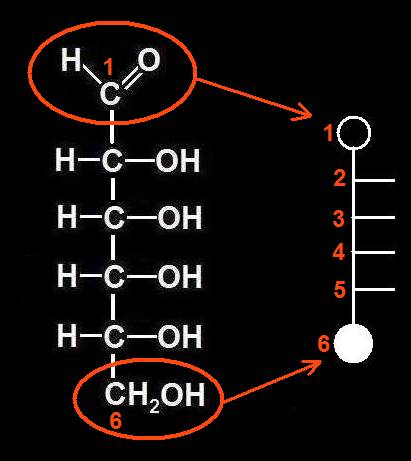
12.- Interprete el siguiente ciclo y deduzca la fórmula abierta correspondiente.
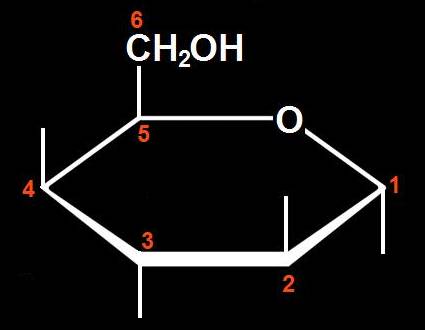
Se trata de una aldohexosa de la serie D. Al abrirse el ciclo se recompone el grupo aldehído, situado en la 1ª posición, quedando el alcohólico primario en la 6ª. Las rayitas de los OH unidos a los carbonos 2 y 4, que están hacia arriba en el ciclo, se sitúan, por convenio, a la izquierda:
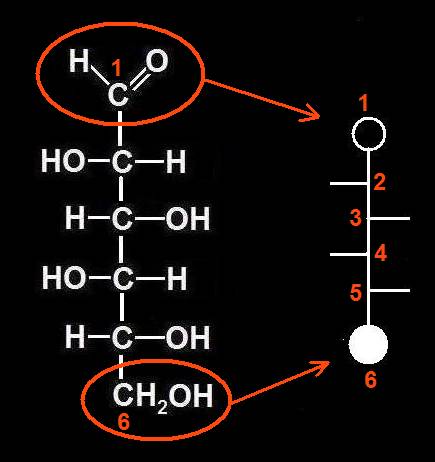
13.- (Consulte su libro). Interprete el modelo siguiente y escriba la fórmula esquemática.
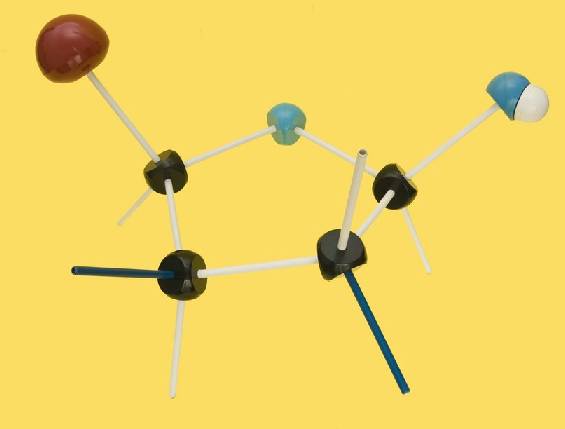
Se trata de una D-aldopentosa ciclada en forma beta, ya que el OH del carbono 1 (anomérico) está por encima del plano pentagonal. Las varillas oscuras marcan las posiciones de los OH, estando el del C2 por debajo del ciclo y el del C3, por encima.
Por consiguiente, la fórmula esquemática del modelo sería así:
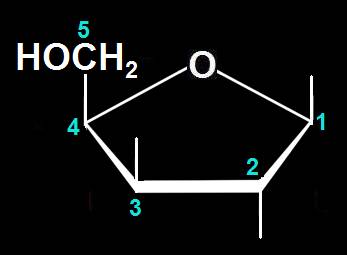
14.- (Consulte su libro). Interprete el modelo siguiente y escriba la fórmula esquemática.
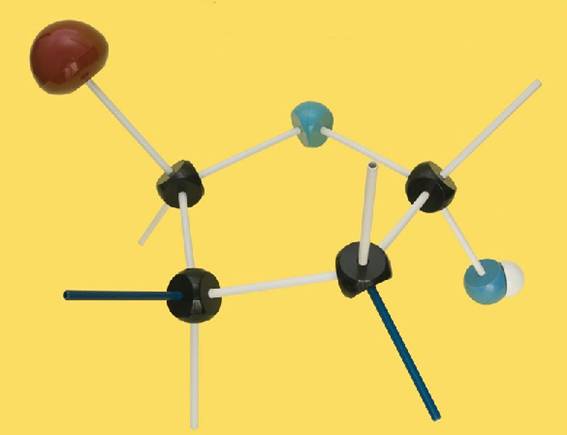
Se trata de una D-aldopentosa ciclada en forma alfa, ya que el OH del carbono 1 (anomérico) está por debajo del plano pentagonal. Las varillas oscuras marcan las posiciones de los OH, estando el del C 2 por debajo del ciclo y el del C 3, por encima.
Por consiguiente, la fórmula esquemática del modelo sería así:
Nota.- Se suele resaltar la parte delantera del anillo pentagonal para sugerir la perpendicularidad con respecto al plano del papel (o pantalla del ordenador).
15.- Interprete el siguiente ciclo y deduzca la fórmula abierta correspondiente.
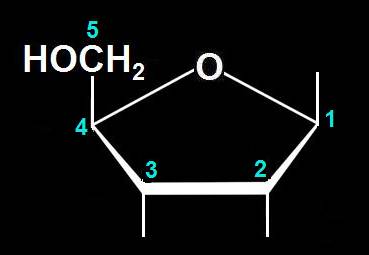
Se trata de una aldopentosa de la serie D. Al abrirse el anillo pentagonal se recompone el grupo aldehído, situado en la 1ª posición, quedando el alcohólico primario en la última. Las rayitas de los OH unidos a los carbonos 2 y 3, que están hacia abajo en el ciclo, se sitúan, por convenio, a la derecha:
16.- Interprete el siguiente ciclo y deduzca la fórmula abierta correspondiente.
Se trata de una aldopentosa de la serie D. Al abrirse el ciclo por el carbono anomérico (1ª posición) se recompone el grupo aldehído. Las rayitas de los OH unidos a los carbonos 2 y 3, que están hacia arriba en el ciclo, se sitúan, por convenio, a la izquierda:
17.- Interprete la siguiente fórmula esquemática y represente el ciclo correspondiente.
Se trata de una aldopentosa de la serie D (la rayita del OH del penúltimo carbono, C 4, está a la derecha). Los grupos reaccionantes para la formación del hemiacetal intramolecular (anomerización) están en las posiciones 1 (aldehído) y 4 (hidroxilo).
Dibujamos el pentágono correspondiente y situamos las rayitas 2 y 3, según el convenio: "izquierda <–> arriba" y "derecha <–> abajo".
Como en el enunciado no se precisa anómero, α o β, elegimos uno de ellos (α, con el OH del C1 hacia abajo).
18.- Escriba la fórmula desarrollada correspondiente a la esquemática adjunta, señale los grupos reaccionantes e identifique las partes del hemiacetal.
Se trata de una aldohexosa de la serie D (concretamente, D-galactosa). En disolución acuosa, los grupos reaccionantes que formarán el hemiacetal son el aldehído (C1) y el OH unido al C5 (probablemente):
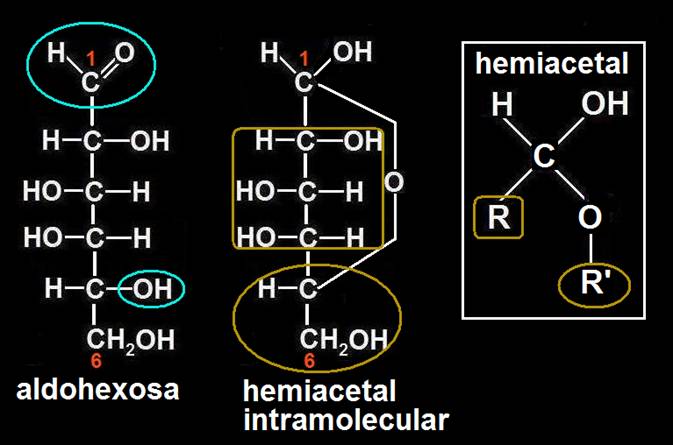
Se observa que el anillo hexagonal está definido por el oxígeno y cinco carbonos: O-C1-C2-C3-C4-C5-O.
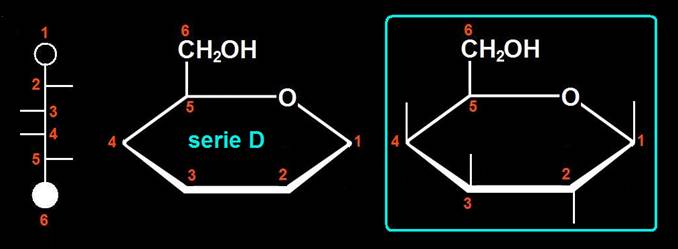
19.- Represente de manera esquemática el anómero β (beta) correspondiente a la pregunta anterior.
Las aldohexosas suelen representarse con un ciclo hexagonal y las rayitas (-OH) se colocan según el convenio: "izquierda <–> arriba y derecha <–> abajo".
El grupo alcohólico primario queda fuera del ciclo y, en la serie D, se sitúa por encima de dicho plano. El anómero β es el que presenta el OH de la posición 1 hacia arriba:
20.- ¿Qué es un hemicetal?
El hemicetal se forma al reaccionar el grupo alcohólico con otro cetónico, originándose un carbono hemicetálico, que es asimétrico dado que presenta los 4 sustituyentes distintos (en disposición tetraédrica). Esta reacción no implica pérdida ni ganancia de átomos, sino una reorganización de los mismos.
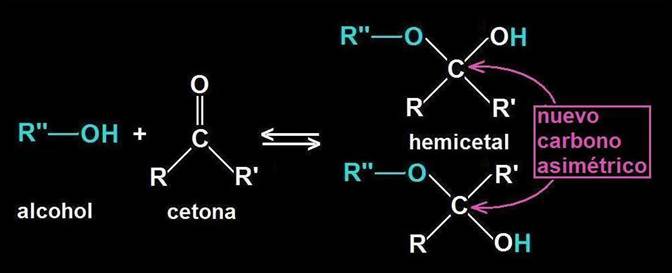
Debido a la estructura tetraédrica del átomo de carbono, el grupo OH de nueva formación puede quedar por encima o por debajo del plano definido por R−C−O−R’’.
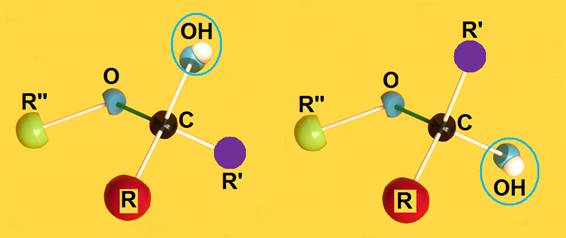
21.- ¿A qué se llama hemicetal intramolecular?
Cuando los grupos reaccionantes pertenecen al mismo compuesto se forma un hemicetal intramolecular, quedando ciclado:
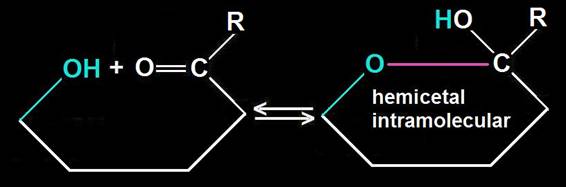
El OH de nueva formación puede quedar por debajo o por encima del plano del anillo, circunstancia que determinará dos anómeros: alfa (α) y beta (β).
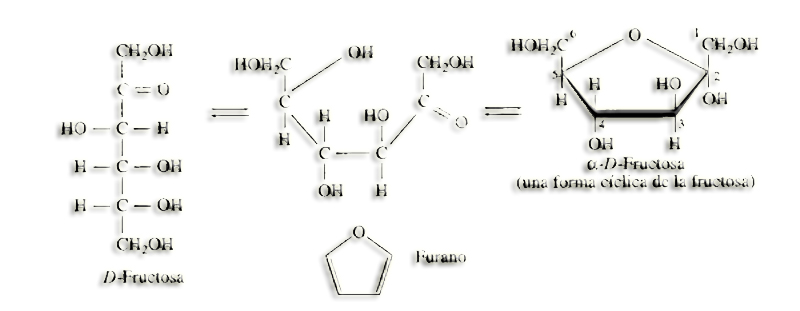
Nota.- En los libros de texto hay buenas ilustraciones, por ejemplo:
22.- Interprete la siguiente fórmula esquemática, numere las posiciones y represente la desarrollada. ¿Podría quedar ciclada? Justifique la respuesta.
Se trata de una cetohexosa de la serie D (el OH de la penúltima posición está a la derecha). En cada extremo hay un grupo alcohólico primario, y en la posición 2, el grupo carbonilo (C=O), siendo la fórmula desarrollada:
En disolución acuosa se ciclaría al reaccionar el grupo carbonilo con el hidroxilo (-OH) unido al C5 (probablemente), formando un hemicetal intramolecular:
Se observa que el oxígeno une las posiciones 2 y 5, definiendo un anillo pentagonal: O-C2-C3-C4-C5-O.
23.- Cicle en forma beta la molécula cuya fórmula esquemática se adjunta. Razone la respuesta.

Se trata de una D-cetohexosa. Según la pregunta anterior se formaría un anillo pentagonal, con el oxígeno unido a C2 y C5.
El anómero beta es el que presenta el OH de la posición 2 hacia arriba. Las rayitas (-OH) de las posiciones 3 y 4 se sitúan según el convenio ya citado.
24.- Cicle en forma alfa la molécula cuya fórmula esquemática se adjunta. Razone la respuesta.
Se trata de una cetohexosa de la serie D, que al ciclarse originaría un anillo pentagonal, según las dos preguntas anteriores. El oxígeno une las posiciones 5 y 2.
El anómero α es el que presenta el OH unido al C2 hacia abajo. Los OH de las posiciones 3 y 4 quedarían hacia arriba.
25.- (Internet: “Nobelprize.org”). Busque información sobre el Nobel de Química de 1937 y dé un vistazo a lo que hay sobre carbohidratos en la Nobel Lecture. Escriba las siguientes fórmulas como están en dicho documento: pirano, furano, α-arabifuranosa, α-glucopiranosa, β-glucopiranos y β-fructofuranosa.
El Nobel de Química de 1937 fue compartido por Norman Haworth y Paul Karrer.

Walter Norman Haworth (1889-1950)
El título de la lectura de Haworth, acto realizado el 11 de diciembre de 1937, fue “La estructura de los carbohidratos y de la vitamina C”, que presenta numerosas fórmulas. Las que se piden en el enunciado son:
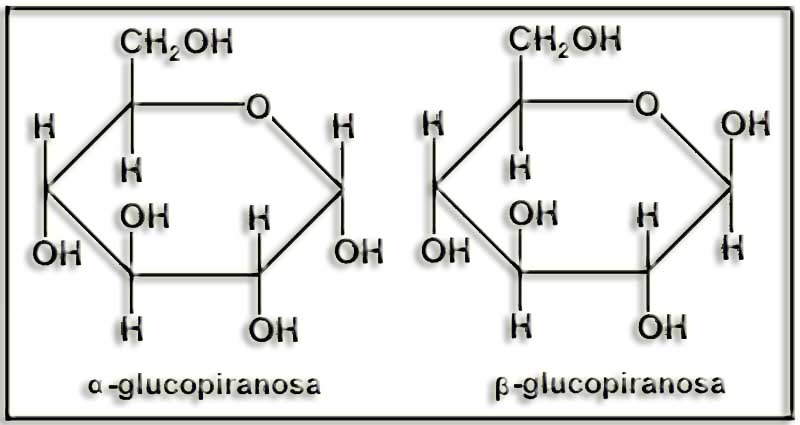
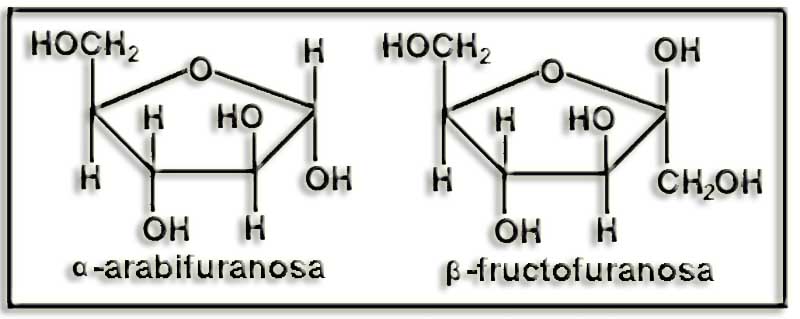
26.- Esquematice todo lo posible las fórmulas de la pregunta anterior.
Si en los ciclos se representan los OH mediante rayitas y se eliminan los H y los carbonos, las fórmulas quedarían así:
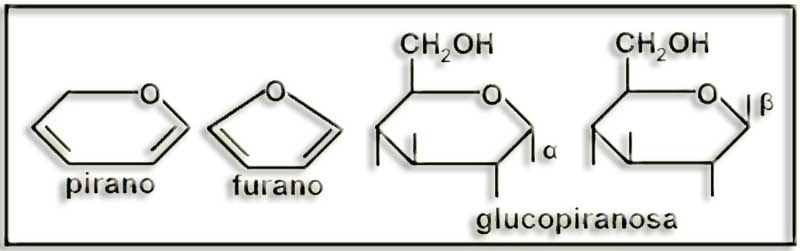
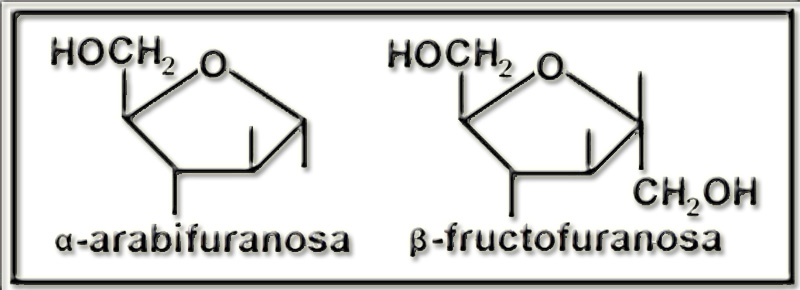
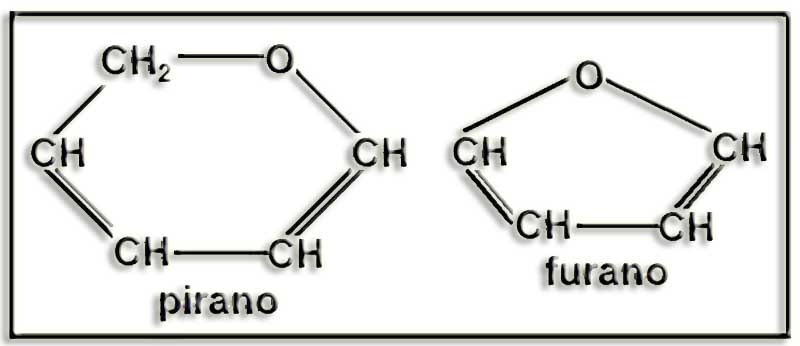
27.- ¿Qué son furanosas y piranosas? ¿Son planos sus anillos?
En general, cuando se ciclan las aldopentosas y las cetohexosas forman anillos pentagonales que, por su parecido con el furano, se denominan furanosas, mientras que en el caso de las aldohexosas son hexagonales, parecidos al pirano, por lo que se llaman piranosas.
Las representaciones de Haworth no son totalmente correctas, pues los anillos no son planos debido a los ángulos de enlace entre los carbonos.
Los anillos piranósicos adoptan conformaciones en forma de silla y de bote, nave o bañera, siendo más estable la primera. Los furanósicos adoptan la conformación de sobre o media silla.
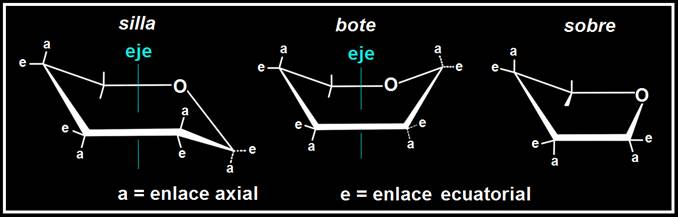
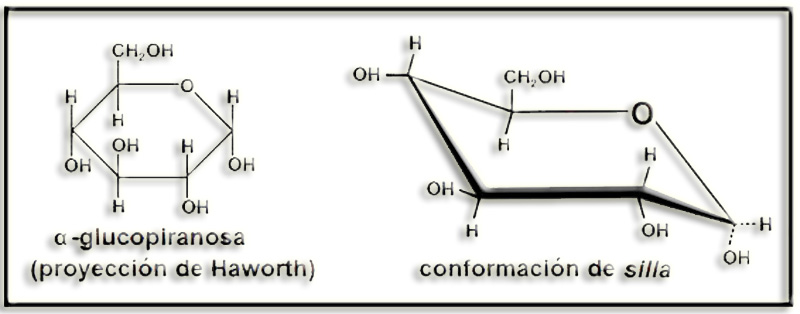
28.- Consulte su libro para formular la α-glucopiranosa en proyección de Haworth y en conformación de silla.
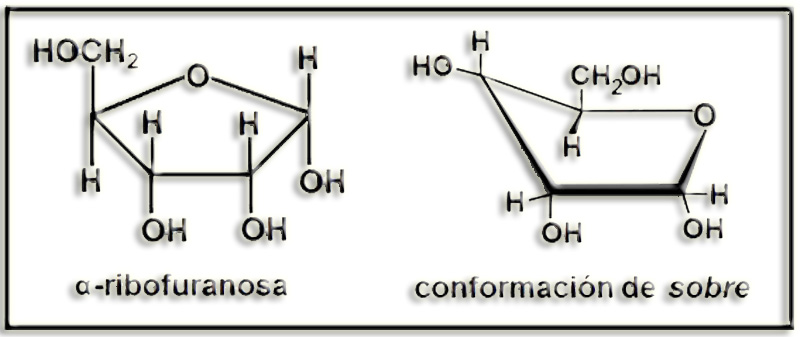
29.- Consulte su libro y formule la α-ribofuranosa en proyección de Haworth y en conformación de sobre.
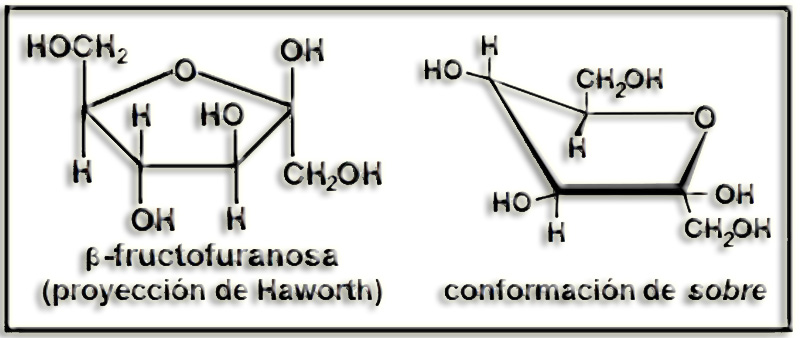
30.- Consulte su libro y formule la β-fructofuranosa en proyección de Haworth y en conformación de sobre.
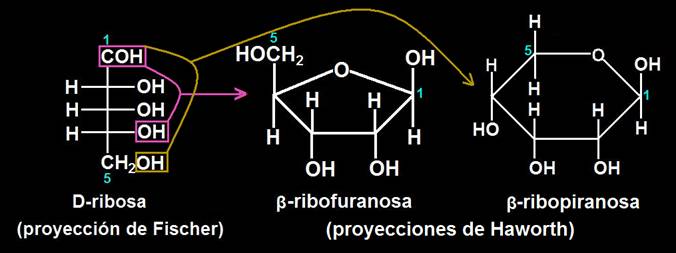
31.- Formule la D-ribosa según la proyección de Fischer. ¿Al ciclarse originará un anillo pentagonal o hexagonal? Razone la respuesta.
La D-ribosa es una aldopentosa con los OH de los tres carbonos asimétricos (C2, C3 y C4) hacia la derecha.
Los grupos reaccionantes para la formación del ciclo son el aldehído (C1) y el OH del C4, o bien, más raramente, el del C5, dado que debido a la estructura tetraédrica del carbono sólo se pueden formar anillos pentagonales (furanósicos) o hexagonales (piranósicos).
En consecuencia, el oxígeno del ciclo está unido a C1 y C4, originando una furanosa, o bien, a C1 y C5, dando lugar a una piranosa:
32.- Represente de manera más esquemática las fórmulas de la pregunta anterior.
La mayor simplicidad se consigue eliminando los H y poniendo rayitas en lugar de los OH.
O sea:
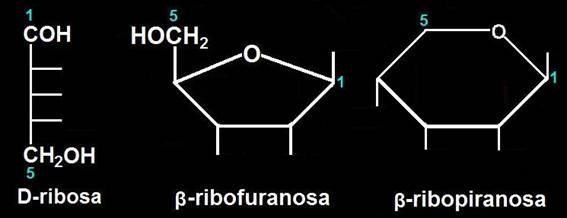
Nota.- Se suele resaltar la parte delantera del polígono para sugerir la perpendicularidad con respecto al plano del papel (o pantalla del ordenador):
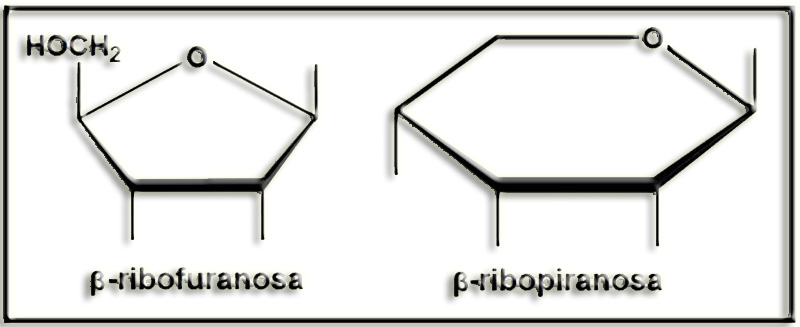
33.- En un Atlas de Biología aparece la fórmula adjunta. ¿De qué anómero se trata? Escriba su nombre y deduzca la proyección de Fischer. Justifique la respuesta.
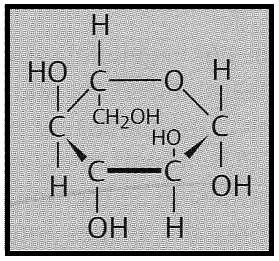
El anillo es hexagonal y el oxígeno referencial une las posiciones C1 y C5, lo cual quiere decir que se trata de una aldohexosa ciclada en forma de piranosa. El grupo alcohólico primario (posición 6) no está por encima del anillo sino por debajo, lo que es propio de la serie L.
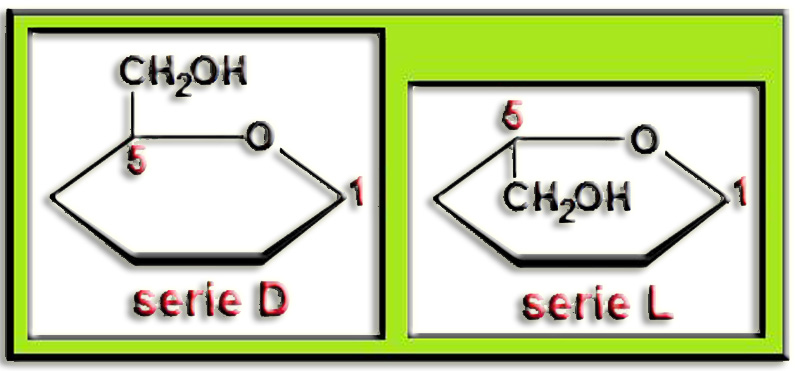
Para situar los OH en las fórmulas lineales y cíclicas se aplica el convenio: "izquierda <–> arriba y derecha <–> abajo". En el ciclo, los OH de C2 y C4 están hacia arriba y el de C3 hacia abajo. El OH del C1 desaparece al abrirse el anillo y recomponer el grupo aldehído. El OH del C5 corresponde a la serie L.
Aplicando todo ello resulta la fórmula esquemática (rayitas = OH) y la proyección de Fischer correspondiente a la L-glucosa.
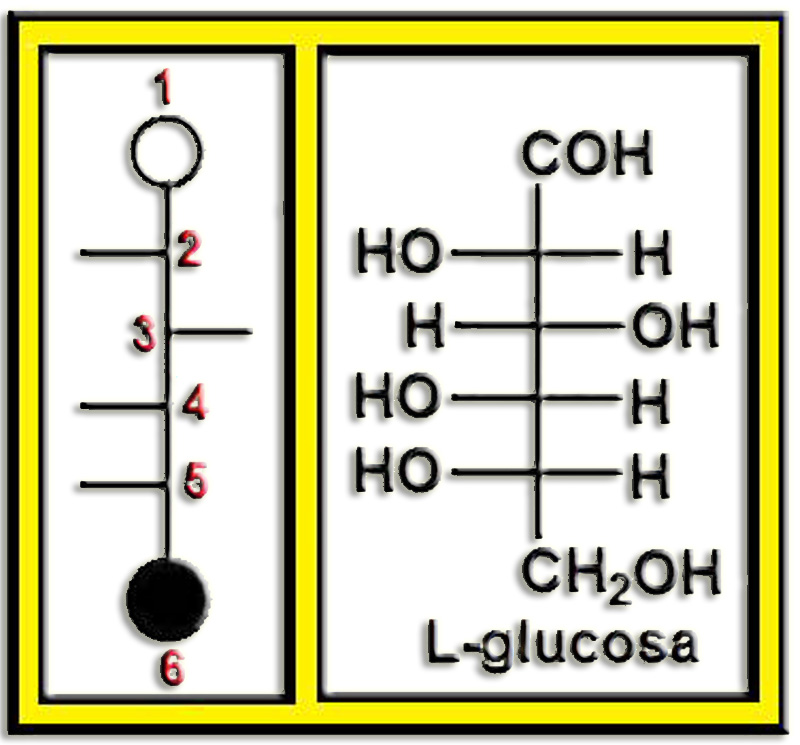
Ya sabemos que se trata de la L-glucopiranosa y sólo queda identificar el anómero (α, β) de la fórmula dada en el enunciado, para lo cual hay que observar este esquema referencial:
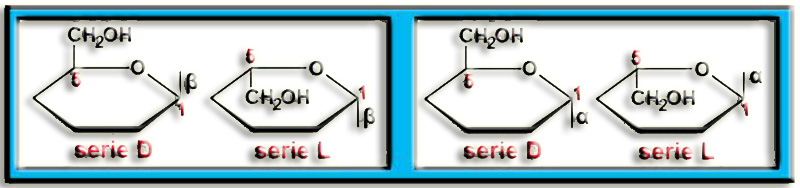
El anómero β queda en posición cis con respecto al grupo alcohólico primario, es decir, ambos por encima del anillo (serie D) o por debajo (serie L), mientras que el anómero α está en posición trans.
La fórmula propuesta corresponde al anómero β de la serie L. Por consiguiente, el nombre completo es: β-L-glucopiranosa.