Proteínas 2 (soluciones)
1.- Enlace peptídico.
Los aminoácidos de una proteína están enlazados mediante uniones amida, llamadas enlaces peptídicos. Por convenio, el primer aminoácido de la cadena es el que presenta el grupo amino libre (-NH2).
El enlace peptídico consiste en un enlace covalente que se establece entre el grupo carboxilo de un aminoácido y el amino de otro, liberándose una molécula de agua. Al unirse dos aminoácidos resulta un dipéptido:
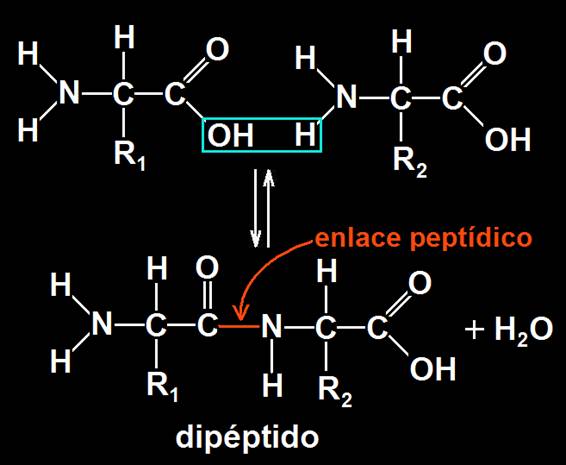
El enlace peptídico se estabiliza por resonancia y, como consecuencia, es rígido (no admite giros) y los cuatro 4 átomos del grupo péptido (OC-NH) y los dos limítrofes de carbono alfa quedan en el mismo plano. Así, pues, el enlace peptídico presenta una doble característica: es plano y rígido.
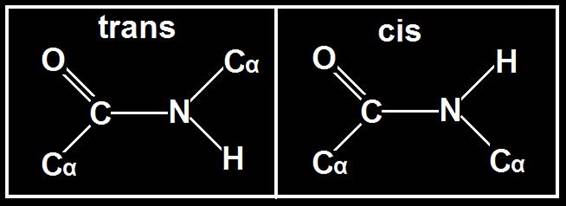
Además, en la configuración “trans” el impedimento estérico es mínimo y la estabilidad mayor. Esto hace que los grupos R estén situados alternativamente a uno y otro lado del “esqueleto” peptídico, aunque por cuestiones prácticas suele omitirse tal circunstancia.
Cuando se trate de una cadena peptídica, ésta puede girar alrededor de los carbonos alfa, por lo que puede adoptar numerosas formas posibles, algunas más estables que otras.
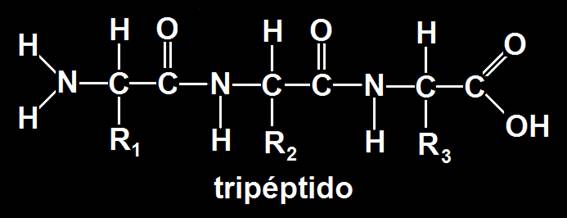
2.- Representar tres aminoácidos unidos.
En este caso se establecen dos enlaces peptídicos y resulta un tripéptido.
3.- Formular: Ala-Gly-Ala. ¿Cuál es su nombre? ¿A qué se llama residuo?
• Según el modelo anterior, se sustituye el grupo R por el correspondiente a los aminoácidos indicados.
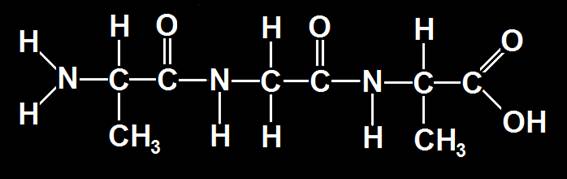
• Se trata del tripéptido: alanil-glicil-alanina (el último aminoácido de la cadena se designa con su nombre completo).
• Se llama residuo al aminoácido que forma parte de un péptido (para diferenciarlo de su forma libre).
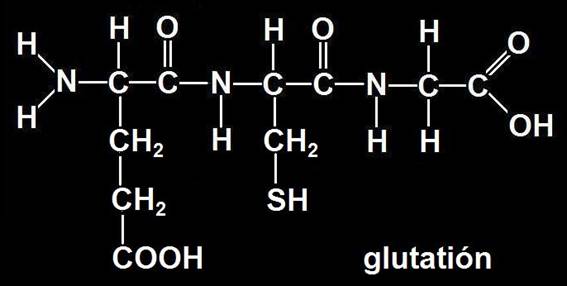
4.- Formular: glutamil-cisteinil-glicina.
Se trata del tripéptido llamado glutatión, que está formado por glutámico, cisteína y glicina. El poder reductor del glutatión depende principalmente del grupo −SH (tiol) de la cisteína.
5.- Escriba la fórmula desarrollada y la molecular de los siguientes aminoácidos: glicina, alanina y serina. Calcule también la masa molecular (masas atómicas: C = 12 u, N = 14 u, O = 16 u, H = 1 u).
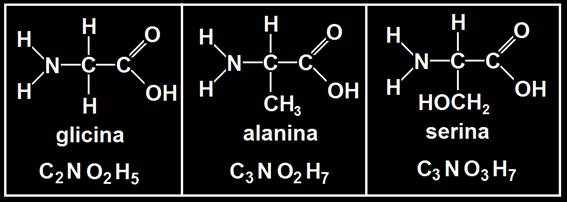
• Gly: 2x12u + 1x14u + 2x16 u + 5x1u = 75 u (unidades de masa atómica).
• Ala: 3x12 + 1x14 + 2x16 + 7x1 = 89 u.
• Ser: 3x12 + 1x14 + 3x16 + 7x1 = 105 u.
6.- Calcular la masa molecular de una cadena formada por 7 serinas.
Según el ejercicio anterior, Ser = 105 u. Se liberan 6 moléculas de agua (una por cada enlace peptídico).
Cadena (heptapéptido): 7x105 − 6x18 = 735 − 108 = 627 u (unidades de masa atómica).
7.- Formular el tetrapéptido: Gly-Ala-Gly-Ala. Calcular la masa molecular.
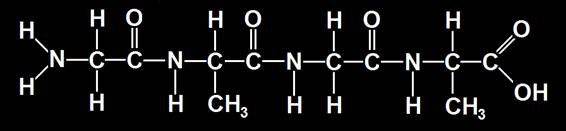
Gly = 75 u. Ala = 89 u. Hay 3 enlaces peptídicos (se libera agua en cada uno). Por lo tanto:
Tetrapéptido: 2x75 + 2x89 − 3x18 = 150 + 178 − 54 = 274 u (unidades de masa atómica).
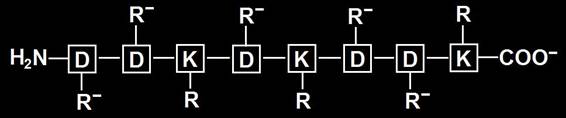
8.- Consulte su libro e interprete la cadena peptídica adjunta. Represéntela con las cargas eléctricas a pH neutro e indique la carga neta.
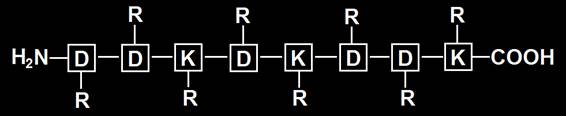
• Se trata de un octapéptido, o sea, una cadena formada por 8 aminoácidos: 5 aspárticos (D) y 3 lisinas (K). Las posiciones 1ª, 2ª, 4ª, 6ª y 7ª están ocupadas por D, y las 3ª, 5ª y 8ª por K. Por convención, el residuo aminoterminal se considera el 1º de la cadena y el carboxilo terminal, el último.
• Al pH neutro estarían ionizados los grupos amino y carboxilo. El grupo amino se protonará y el grupo carboxilo (COOH), se disociará (COO−). El grupo R del aspártico, por llevar un grupo carboxilo, quedará como R−. El R de la lisina posee un grupo amino, por lo que acepta un protón y adquiere carga positiva (R+).
• Por consiguiente, a pH 7 (neutro) la cadena estaría con 6 cargas negativas y 4 positivas: la carga eléctrica neta es 2–.
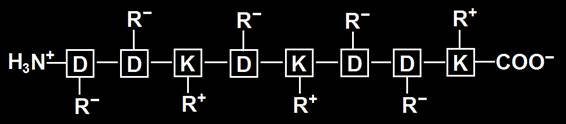
9.- Represente la cadena del ejercicio anterior a pH muy ácido (≈1) y muy básico (≈13). Indique en ambos casos la carga eléctrica.
• Al pH 1, con exceso de hidrogeniones en el medio, el grupo COOH no se disociará, quedando sin carga el grupo R de los 5 aspárticos, mientras que el grupo amino inicial y el del radical de las 3 lisinas, quedarán protonados. La carga es 4+.
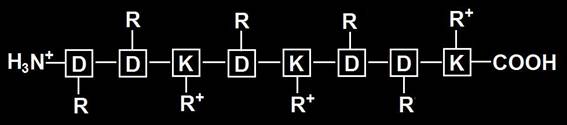
• Al pH 13, dada la escasez de hidrogeniones, los grupos amino (el inicial y el del radical de las 3 lisinas) no se protonará (R), mientras que el carboxilo se disociará liberando un hidrogenión, quedando como COO- terminal y 5 R- de sendos aspárticos. La carga es 6–.
10.- ¿A qué se llama punto isoeléctrico de una cadena peptídica? Con los valores deducidos en los dos ejercicios anteriores elabore una gráfica y señale, aproximadamente, el punto isoeléctrico.
• Punto isoeléctrico es el valor del pH que determina que la carga eléctrica neta de la cadena sea nula.
Según los ejercicios anteriores:
A pH≈1 (muy ácido), la carga es +4.
A pH=7 (neutro), la carga neta es −2.
A pH≈13 (muy básico), la carga es −6.
• Marcando estos valores en los ejes resulta la siguiente representación gráfica:
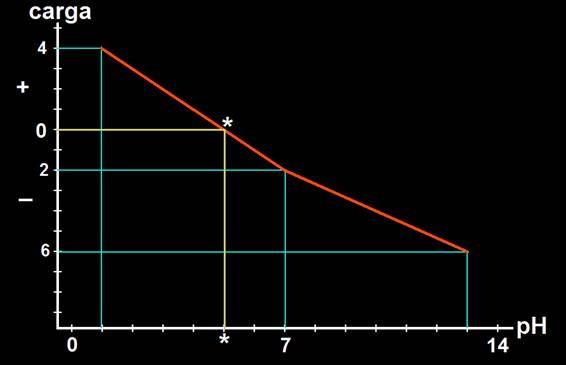
Conclusión: el punto isoeléctrico (*) quedaría situado en torno al valor 5 de pH, observándose la correspondencia con la carga eléctrica neta igual a cero.
11.- Obtenga gráficamente el punto isoeléctrico aproximado de una cadena peptídica formada por 2 glutámicos y 7 lisinas.
A pH 7 todos los grupos que puedan ionizarse, lo harán. La carga neta es +5. Esquemáticamente:

A pH 1 sólo habrá cargas +, pues el grupo COOH no está disociado, pero los grupos amino están protonados. La carga es +8.

A pH 13, a consecuencia de la disociación de los grupos carboxilo, sólo habrá cargas negativas, pues el grupo amino inicial y el del radical de las lisinas estará sin carga. La carga eléctrica neta sería −3.

• Con tales valores se realiza la gráfica siguiente:
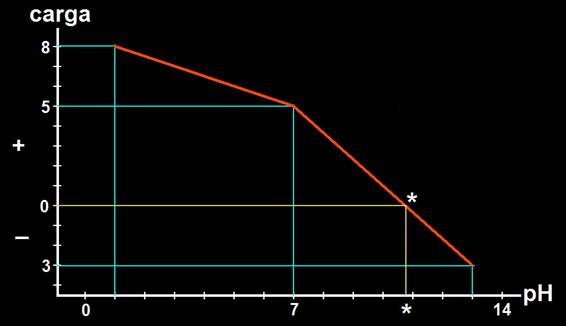
• Conclusión: el punto isoeléctrico (*) estaría entre el pH 10 y 11.
12.- Clasificación de los péptidos.
Las cadenas peptídicas se pueden clasificar así:
• Aminoácidos o monopéptidos. Son las unidades estructurales.
• Oligopéptidos. Formados por 2-20 aminoácidos. Reciben diversos nombres para precisar el número de residuos integrantes: dipéptidos, tripéptidos, tetrapéptidos, pentapéptidos, etc.
• Polipéptidos. Cadenas integradas por 20-100 aminoácidos.
• Macropéptidos o proteínas. Cadenas formadas por más de 100 aminoácidos (en general, entre 100 y 300, aunque las hay con más de 1000).
Nota.- Los intervalos anteriores son orientativos, pues hay autores que llaman oligopéptidos a las cadenas hasta con 15-20 aminoácidos, polipéptidos si tienen de 15 a 50, y proteínas cuando hay más de 50.
13.- Funciones biológicas de los péptidos.
Son muy variadas:
• Agentes vasoactivos. La angiotensina II es un octapéptido con función hipertensora (vasoconstrictora), que se origina mediante activación proteolítica de un precursor (angiotensinógeno).
• Hormonas. Muchos péptidos actúan como reguladores de los procesos fisiológicos. Así, por ejemplo: glucagón, insulina, oxitocina, adiuretina, etc.
• Neurotransmisores. Las encefalinas son pentapéptidos que se liberan en las sinapsis y ejercen su acción sobre la neurona post-sináptica, induciendo así la generación de un nuevo impulso nervioso.
• Antioxidante. El glutatión es un tripéptido que actúa como antioxidante celular, gracias al grupo SH de la cisteína:
H2O2+ GSH + GSH <—> 2 H2O + GS-SG
• Antibióticos. La valinomicina y la gramicidina son dos péptidos cíclicos con acción antibiótica. Ambos contienen aminoácidos de la serie D, además de otros que no son proteicos.
14.- Breve comentario sobre la oxitocina y la adiuretina.
• La oxitocina (del griego oxys, rápido y tokos, parto) es un nonapéptido que se produce en la hipófisis posterior o neurohipófisis. Su acción hormonal provoca la contracción de la musculatura uterina, induciendo el parto.
• La hormona antidiurética o adiuretina es un nonapéptido, que se origina en la neurohipófisis. Induce la reabsorción de agua en los túbulos renales. Cuando falta se produce mucha orina (poliuria), lo cual provoca una sed intensa y frecuente (polidipsia). Esta anomalía fisiológica se conoce como “diabetes insípida”.
15.- Breve comentario sobre el glucagón.
El glucagón es un polipéptido formado por 29 aminoácidos. Esta hormona se produce en el páncreas, concretamente en las células alfa de los islotes de Langerhans. Su acción es hiperglucemiante: provoca que en el hígado el glucógeno se hidrolice para aportar glucosa a la sangre.
Nota.- Los islotes pancreáticos fueron descritos por Langerhans en 1869.
16.- Breve comentario sobre la insulina.
La insulina fue primer péptido que se secuenció, descubrimiento realizado por el bioquímico inglés F. Sanger (Nobel de Química en 1958). Está formada por dos cadenas peptídicas, la A con 21 aminoácidos y la B con 30, en suma, 51 aminoácidos. Ambas cadenas están unidas por puentes disulfuro.
La insulina es una hormona que se produce en el páncreas, concretamente en las células beta de los islotes de Langerhans. Su acción es hipoglucemiante, puesto que facilita la entrada de glucosa en las células. Su déficit causa “diabetes mellitus”, que se caracteriza por hiperglucemia y glucosuria (presencia de glucosa en la orina).
Nota.- En 1889 Von Mering y Minkowski demostraron que la extirpación del páncreas en un perro originaba la aparición de azúcar en la orina, es decir, una diabetes mellitus.
17.- ¿Cuál es la enfermedad "del hambre en medio de la abundancia"?
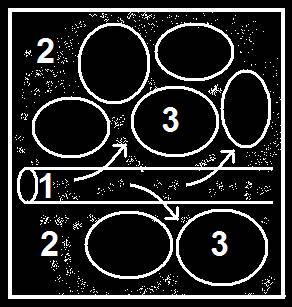
Esta expresión se refiere a la diabetes mellitus. Como puede verse en el esquema adjunto, la glucosa, representada mediante un fino punteado, se acumula en la sangre y desde los capilares sanguíneos (1) difunde hacia el plasma intersticial (2). Al faltar insulina la glucosa no puede entrar en las células (3), las cuales quedan “hambrientas” de azúcar pese a la abundancia de glucosa en el medio circundante.
18.- ¿Se sintetiza como tal la insulina?
Lo que se sintetiza primeramente es un precursor inactivo, llamado preproinsulina, que pierde la secuencia señal del extremo amino terminal y se convierte en proinsulina, cuya cadena se pliega y forma 3 puentes disulfuro (uno intracatenario y dos intercatenarios). La cadena peptídica sufre después un corte proteolítico, eliminando el llamado péptido C, siendo entonces funcional la hormona insulina, integrada por 51 aminoácidos.
19.- Interprete el siguiente esquema y aclare el significado de los asteriscos.
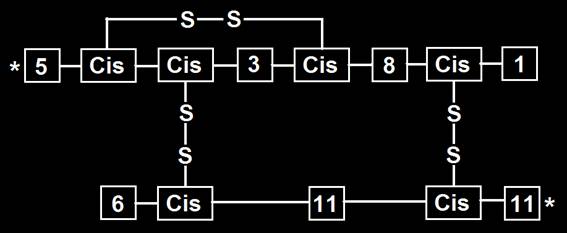
Se trata de dos cadenas acopladas y 51 aminoácidos en total. La cadena A (superior) consta de 21 y la B (inferior), de 30. El esquema corresponde a la insulina.
En la cadena A se observa un enlace disulfuro intracatenario, entre los residuos de cisteína de las posiciones 6 y 11.
Hay dos puentes disulfuro intercatenarios, establecidos entre los residuos 7A−7B y 20A−19B.
Cada asterisco representa el sitio de unión del péptido C, que se elimina de la molécula precursora (proinsulina) por corte proteolítico.
20.- ¿Cuál es la función de la insulina?
• La insulina posibilita la entrada de glucosa en las células y, en el hígado y en los músculos, favorece su almacenamiento en forma de glucógeno.
• La insulina también estimula la síntesis de ácidos grasos en el hígado, que posteriormente son transportados a los adipocitos. Además, favorece la entrada de ciertos aminoácidos en las células, lo cual normalizará la biosíntesis de proteínas.
Así, pues, la insulina afecta al metabolismo de los glúcidos, lípidos y proteínas, aunque lo cierto es que se habla más de ella por sus efectos sobre la glucosa en la sangre.
21.- ¿Es posible que el páncreas de un diabético produzca insulina?
No en la diabetes tipo 1 (insulino-dependiente), pues las células beta del páncreas no la producen o lo hacen en cantidad muy escasa. Estos pacientes presentan hiperglucemia y además de controlar la dieta necesitan aportes periódicos de insulina mediante inyectables. La diabetes tipo 1 afecta al 10% de la población diabética total y suele aparecer antes de los 30 años.
En la dibetes tipo 2 (no insulino-dependiente) suele aparecer después de los 40 años, aumentando su frecuencia con la edad. La causa puede deberse a la falta de receptores hormonales apropiados para desencadenar la acción de la insulina. A esto se llama insulinorresistencia (IR).
En la resistencia a la insulina (o resistencia a la captación de glucosa estimulada por insulina) influyen los siguientes factores: inactividad física, obesidad, edad, medicamentos, aunque hoy se acepta que la causa principal es genética.
La hiperglucemia derivada de la IR induce al páncreas para que libere más insulina, pero ésta no puede ejercer su acción y la glucosa no entra en las células. De nuevo sube la glucemia y el páncreas activa la secreción de insulina, estableciéndose el binomio hiperglucemia−hiperinsulinemia. Esta hiperinsulinemia secundaria a la aparición de resistencia podrá desencadenar otras anomalías fisiológicas y provocar hipertensión.
22.- ¿Cómo favorece la insulina la entrada de glucosa en las células?
La entrada de glucosa en la célula requiere un transportador específico (GLUT4). La insulina se acopla a un receptor localizado en la membrana plasmática de las células diana. La unión hormona-receptor provoca fosforilaciones, activándose las proteínas IRS (sustratos del receptor de insulina). Las IRS fosforiladas activan a unas kinasas concretas, que entre otras funciones promueven la translocación a la membrana de los transportadores GLUT4, imprescindibles para la entrada de la glucosa.




