Proteínas 1 (soluciones)
1.- ¿Qué son proteínas?
Las proteínas son biomoléculas orgánicas poliméricas formadas por la unión de numerosas unidades estructurales llamadas aminoácidos. Estos polímeros suelen tener más de 100 monómeros y el conjunto adopta un plegado tridimensional característico para ser funcional.
2.- ¿Qué son aminoácidos?¿Cuántos hay? ¿Cuál es la fórmula general?
• Los aminoácidos son las unidades estructurales de las proteínas. Por hidrólisis de las mismas se han identificado 20 aminoácidos distintos, llamados proteicos o proteinógenos.
• Se conocen unos 150 aminoácidos, pero sólo 20 de ellos forman parte de las proteínas.
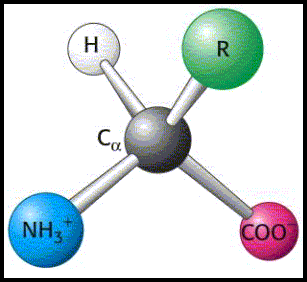
• Cada uno de los aminoácidos proteicos posee dos grupos funcionales característicos, el amino y el carboxilo (-COOH), unidos al mismo átomo de carbono (llamado alfa). Dado que ambos grupos están ionizados a pH fisiológico (≈7), la fórmula estructural general de los aminoácidos puede escribirse de dos maneras:

Los aminoácidos se diferencian en el grupo R (radical o cadena lateral). En muchos libros de 2º de Bachillerato, por simplicidad, se omiten las cargas. Es importante tener en cuenta que las representaciones planas se utilizan por cuestiones prácticas, pero la disposición real de los sustituyentes es tetraédrica:
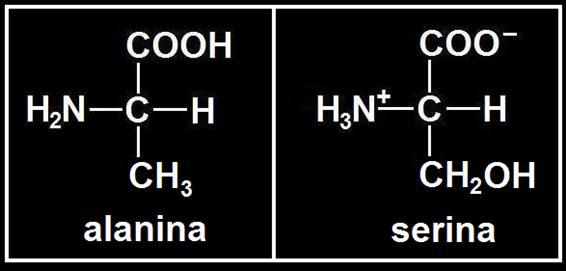
3.- Formular la alanina (sin cargas) y la serina (como ion bipolar), sabiendo que sus radicales son, respectivamente, R = −CH3 y R = −CH2OH.
Hay que sustituir en la fórmula general el grupo R por el indicado en el enunciado:
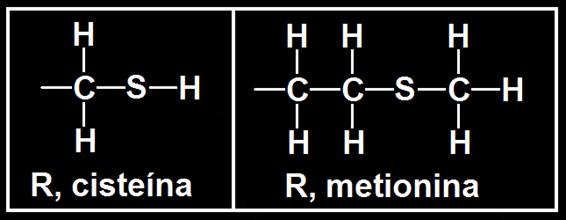
4.- Consulte su libro y escriba la forma desarrollada del grupo R de los aminoácidos azufrados.
Dos aminoácidos contienen azufre, cisteína y metionina, siendo sus radicales:
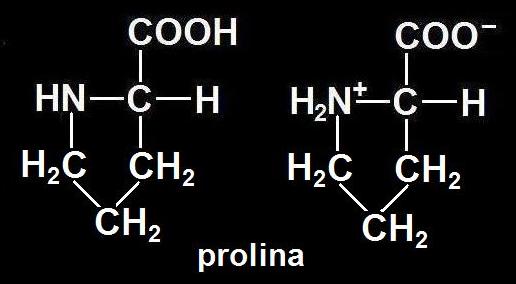
5.- En algunos libros se lee que la prolina es un iminoácido. ¿Es una errata? Escriba la fórmula sin cargas y como ion dipolar.
No es una errata. La prolina carece de grupo amino, pero posee el imino (−NH−), al haberse unido con el radical. Es el único aminoácido de los 20 proteicos que no presenta el grupo R libre, pues forma un ciclo al estar unido también con el grupo amino del carbono alfa. La fórmula de este aminoácido o iminoácido es:
6.- ¿Qué particularidad presenta el carbono alfa (Cα) de los aminoácidos proteicos?
El carbono alfa es asimétrico, puesto que está unido a cuatro sustituyentes distintos (excepto en el caso de la glicocola o glicina, al ser R = H). Por consiguiente, las disoluciones de los aminoácidos (exceptuando el caso citado) presentarán actividad óptica, propiedad que se analiza con el polarímetro.
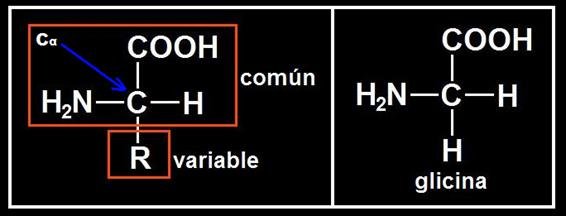
Se observa que los aminoácidos tienen una parte común y otra variable constituida por el grupo R (radical o cadena lateral).
7.- ¿Cuándo se considera que un aminoácido es de la serie D o de la serie L?
Un aminoácido es de la serie D cuando, estando la molécula convenientemente orientada, el grupo amino queda a la derecha del observador. Es de la serie L cuando dicho grupo queda a la izquierda. El grupo carboxilo unido al carbono alfa debe estar arriba, y los sustituyentes H y amino, en el plano horizontal, dirigidos hacia el observador.
Las formas D y L de un mismo aminoácido son imágenes especulares (enantiómeros).
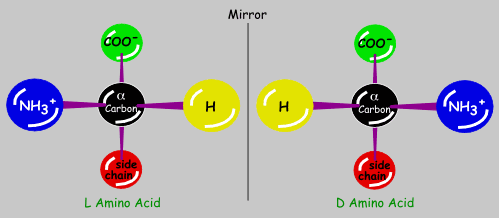
Todas las proteínas de los seres vivos están integradas por aminoácidos de la serie L, pero existen D-aminoácidos en el peptidoglucano (mureína) de las paredes celulares bacterianas.
He aquí otras representaciones de las formas D y L, sin mostrar la ionización de los grupos funcionales:
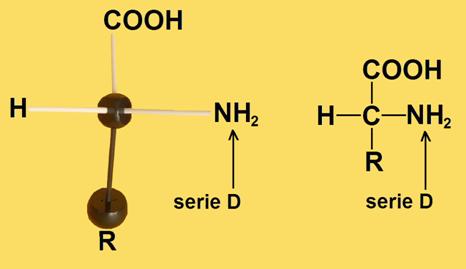
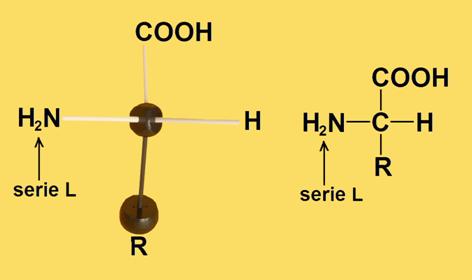
Los símbolos D y L se refieren a la disposición espacial de los 4 grupos sustituyentes unidos al carbono alfa.
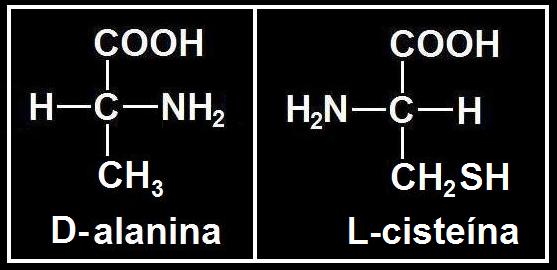
8.- Formular: D-alanina (R = −CH3) y L-cisteína (R = −CH2SH).
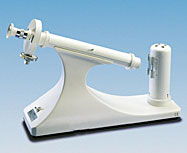
9.- ¿Son dextrógiros los aminoácidos de la serie D y levógiros los de la L?
Las configuraciones D y L de los aminoácidos se refieren a la disposición espacial de los sustituyentes unidos al carbono alfa y no tiene nada que ver con el poder rotatorio, pues son conceptos diferentes. Por ejemplo: L-alanina, L-arginina, L-isoleucina y L-lisina son dextrógiros.
Cuando la luz polarizada atraviesa una disolución de aminoácido, el plano se puede desviar a la derecha ( dextrógiro, +, dextrorrotatorio) o a la izquierda ( levógiro, −, levorrotatorio). Esta actividad óptica se debe a la presencia de carbonos asimétricos y se determina con un polarímetro.
10.- ¿Puede ocurrir que el polarímetro marque “cero” al analizar una disolución de aminoácido?
En tal caso podría tratarse de la glicina, que carece de carbono asimétrico y, por consiguiente, no presenta actividad óptica.
También podría tratarse de una mezcla racémica o racemato, es decir, de una mezcla equimolecular de las formas D y L del mismo aminoácido (enantiómeros), lo cual no provocará ninguna desviación del plano de la luz polarizada, pues uno de ellos hará girar el ángulo hacia la derecha (+) y el otro a la izquierda (−) en la misma magnitud, quedando anulado el poder rotatorio.
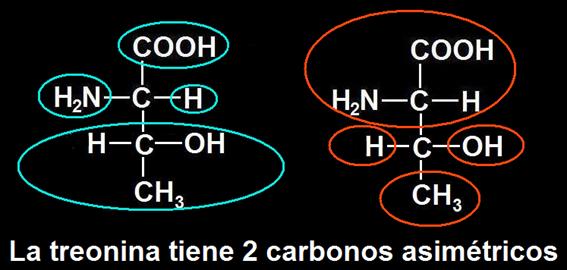
11.- Busque en su libro la fórmula de la treonina y señale los grupos sustituyentes de los carbonos que sean asimétricos.
La treonina, además del carbono α, tiene también el carbono β asimétrico, pues en ambos casos están unidos a radicales o grupos distintos.
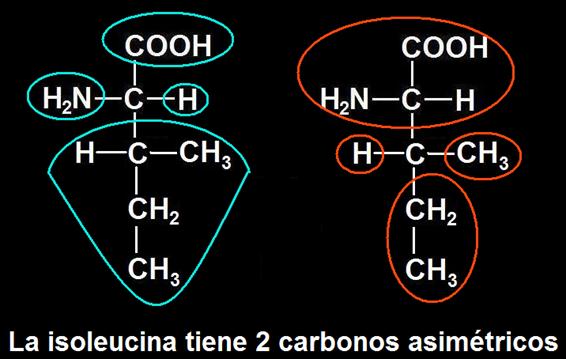
12.- Busque en su libro la fórmula de la isoleucina y marque los grupos sustituyentes de los carbonos asimétricos.
En la isoleucina son asimétricos el carbono α y el β.
13.- ¿Cuántos carbonos asimétricos e isómeros ópticos (estereoisómeros) presentan los aminoácidos?
Considerando los 20 aminoácidos proteinógenos:
La glicina no tiene C asimétrico. Treonina e isoleucina tienen dos (Cα y el siguiente, Cβ). Todos los demás presentan sólo un átomo de carbono asimétrico (Cα).
El número de estereoisómeros es 2n, siendo n el número de C asimétricos.
Glicina, 20 = 1. Treonina e isoleucina, 22 = 4. Restantes, 21 = 2.
Cuando hay dos formas, D y L, en las moléculas de proteína se halla el L-aminoácido. En la treonina e isoleucina aparecen 4 estereoisómeros, pero en las proteínas sólo se halla uno de ellos.
14.- Consulte en su libro la fórmula de la treonina y represente los estereoisómeros.
Como la treonina tiene 2 carbonos asimétricos, hay 4 estereoisómeros (2 de la serie D y 2 de la L). Los enantiómeros son imágenes especulares. He aquí sus fórmulas:
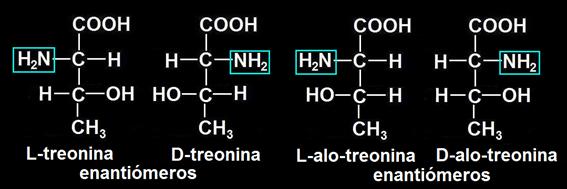
En las proteínas se halla la L-treonina.
15.- Consulte su libro e identifique el modelo molecular adjunto, considerando que la bola roja es R = −CH2−COOH. Clave de colores: negro (C), blanco (H), azul claro (O), azul oscuro (N).
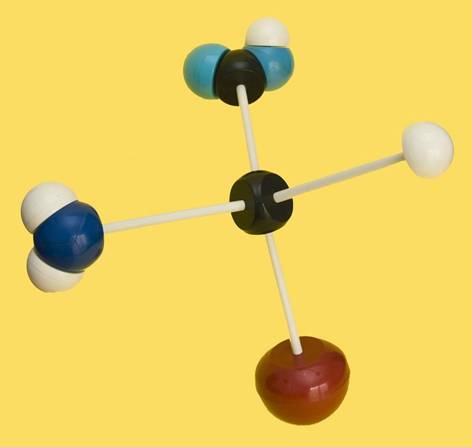
El modelo está bien orientado. El grupo carboxilo (-COOH) está arriba, y el grupo amino, dirigido hacia el observador y en la parte izquierda (serie L). Con el grupo R indicado en el enunciado, se trataría del aminoácido L-aspártico.
16.- (Consulte su libro). Identifique el modelo molecular si la bola roja es R = -CH2-CH2-COOH. Clave de colores: negro (C), blanco (H), azul claro (O), azul oscuro (N).
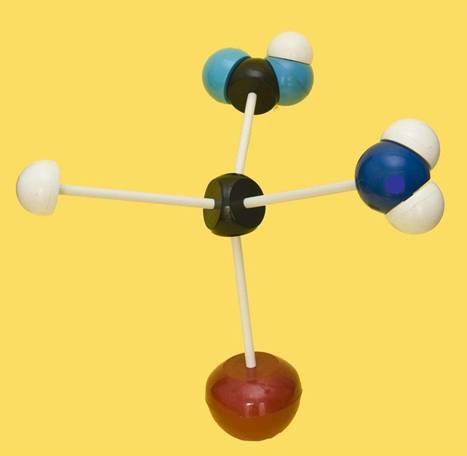
El modelo está bien orientado, observándose el grupo amino a la derecha (serie D). Con el grupo R indicado en el enunciado, se trataría del aminoácido D-glutámico.
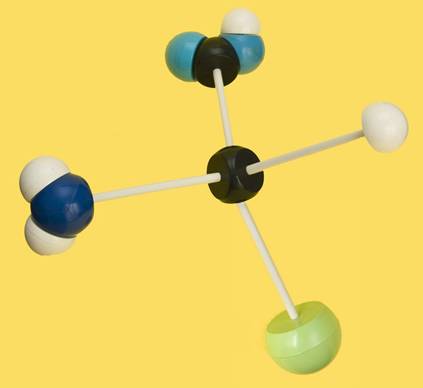
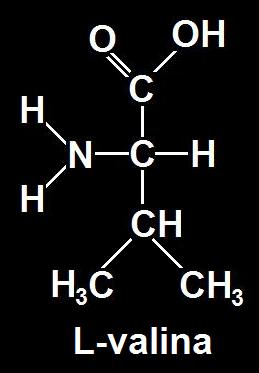
17.- Suponga que el siguiente modelo corresponde al aminoácido valina. Escriba la fórmula desarrollada (consulte su libro para ver el grupo R).
|
|
|
|
18.- Clasificación de los aminoácidos.
Los aminoácidos pueden clasificarse según la polaridad de sus grupos R (radicales):
• Neutros polares. El radical contiene enlaces covalentes polares. No tienen carga eléctrica neta, pero presentan afinidad por el agua. Son 7, por ejemplo: serina (Ser), cisteína (Cys), treonina (Thr).
• Neutros no polares. El radical sólo contiene enlaces covalentes apolares, por lo que es hidrofóbico. Son 8, por ejemplo: alanina (Ala), valina (Val), leucina (Leu).
• Ácidos. El radical lleva un grupo ácido (-COOH), de forma que a pH neutro tiene carga neta negativa. Son 2: aspártico (Asp) y glutámico (Glu).
• Básicos. El radical lleva un grupo básico (amino), por lo que a pH neutro tienen carga eléctrica positiva neta. Son 3: lisina (Lys), histidina (His) y arginina (Arg).
19.- (Consulte su libro). Formular los aminoácidos "Asp" y "Lys" a pH 7 (neutro). ¿Cuál es la carga eléctrica neta?
• “Asp” corresponde al ácido aspártico (aspartato). A pH 7 tiene carga neta 1–.
• “Lys” corresponde al aminoácido básico llamado lisina. Su carga eléctrica neta a pH 7 es 1+.
20.- (Consulte su libro). Escriba el nombre de los aminoácidos correspondientes a estos símbolos: A, D, F, G, K, L, M, P, R, W.
A = alanina (Ala). D = ácido aspártico (Asp). F = fenilalanina (Phe). G = glicina (Gly). L = leucina (Leu). M = metionina (Met). P = prolina (Pro). R = arginina (Arg). W = triptófano (Trp).
21.- identifique el modelo siguiente y escriba su fórmula. Clave de colores: blanco = H, negro = C, azul claro = O, azul oscuro = N.
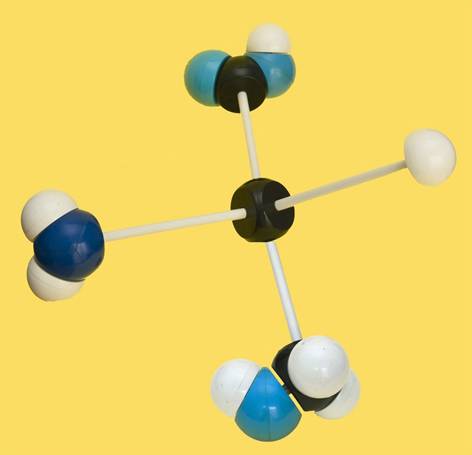
El modelo está bien orientado y se observa que el grupo amino está a la izquierda. Se trata de la L- serina. Su fórmula es:
22.- identifique el modelo siguiente y escriba su fórmula a pH neutro. Clave de colores: blanco = H, negro = C, azul claro = O, azul oscuro = N.
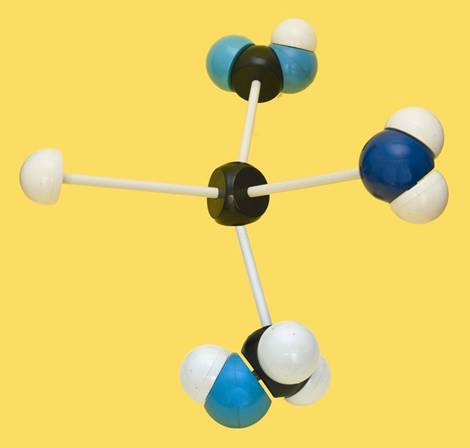
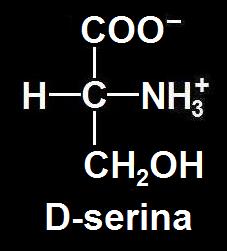
El modelo está bien orientado y se observa que el grupo amino está a la derecha. Se trata de la D-serina. A pH 7 (neutro) los grupos amino y carboxilo estarían ionizados, siendo entonces la fórmula:
23.- ¿Qué significa el término anfótero?
Anfótero significa que los aminoácidos pueden actuar como ácidos y como bases, dependiendo del pH.
En medios acuosos y a pH 7 (neutro) el grupo carboxilo, por su carácter ácido, cede un protón (H+) y adquiere carga negativa, mientras que el grupo amino, por su carácter básico, lo capta y queda con carga positiva.
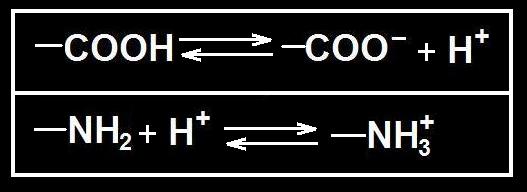
Si el pH es muy ácido, el grupo COO- incorpora un protón (H+) y desaparece la carga negativa (COOH). Cuando el pH se vuelve muy básico, el grupo amino cede un protón y desaparece la carga positiva (NH2).
En el esquema siguiente se observa la forma dipolar iónica a pH neutro de muchos aminoácidos.
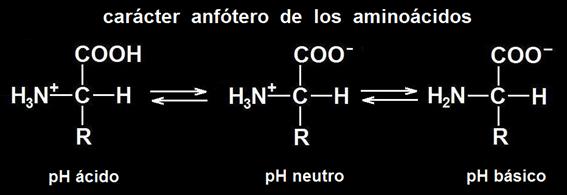
24.- Una de las propiedades más notables de los aminoácidos es su efecto amortiguador o tampón. ¿Qué quiere decir eso? ¿Qué es el punto isoeléctrico?
• Que debido a su comportamiento anfótero, los aminoácidos tienden a mantener constante el pH del medio.
Si se acidifica el medio en el que se encuentra la forma dipolar, el grupo carboxilo ionizado (COO−) capta protones (H+) y amortigua dicha acidificación (COOH).
Si aumenta el pH del medio en el que se encuentra la forma dipolar, el grupo amino ionizado (H3N+) libera protones (H+) y amortigua la alcalinización.
• Se llama punto isoeléctrico al valor del pH en el cual un aminoácido adopta la forma dipolar neutra, esto es, presenta tantas cargas positivas como negativas.
25.- ¿Qué consecuencia tiene que el pH isoeléctrico de la histidina sea alrededor de 7,5?
Ese valor es muy parecido al del pH fisiológico (pH ≈7), por lo que la histidina se puede comportar como una solución tampón.
Precisamente, la hemoglobina debe parte de sus propiedades a la presencia de histidina en cantidades significativas.
26.- Aclare el significado de la siguiente expresión (AA = aminoácido):

• La expresión puede significar que a pH neutro el aminoácido existe en la forma de ion dipolar (+AA−). En este caso, dado que la carga neta es cero, el aminoácido no se desplazaría sometido a la acción de un campo eléctrico.
• Al disminuir el pH del medio (acidificación) cambiaría a la forma catiónica (AA+). Si el pH va aumentando (alcalinización), el aminoácido adoptaría la forma aniónica (AA−).
27.- (En relación con el ejercicio anterior). Al obtener la curva de valoración de un aminoácido se ha determinado que cuando el valor del pH es 2,34 se igualan [AA+] y [+AA−], y que a pH 9,69 son iguales [+AA−] y [AA−]. ¿Cuál es el punto isoeléctrico?
En este tipo de analítica, el pH isoeléctrico (pI) viene dado por la media aritmética de las dos situaciones consideradas en el enunciado. Resulta: pI =6,02.
28.- ¿Son moléculas eléctricamente neutras los aminoácidos a pH neutro?
Depende del grupo R, pues a pH neutro tanto el grupo amino como el carboxilo unidos al carbono alfa están ionizados y presentan carga + y − respectivamente. Por consiguiente, la molécula será neutra si R carece de carga, pero en el caso de los aminoácidos ácidos (R−) o básicos (R+), la carga eléctrica neta será negativa o positiva. O sea:
29.- (Consulte su libro). Escriba la fórmula del aspártico (aspartato) a pH: muy ácido (≈1), neutro y muy básico (≈13).
Debido al carácter ácido del radical del aspártico (R−), la carga neta a pH neutro es negativa.
30.- (Consulte su libro). Escriba la fórmula de la lisina a pH: muy ácido (≈1), neutro y muy básico (≈13).
Debido al carácter básico del radical de la lisina (R+), la carga neta a pH 7 es positiva.
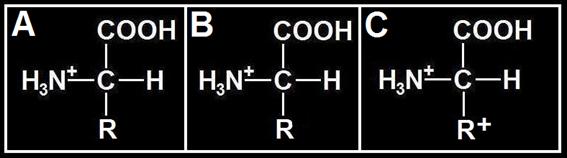
31.- Las fórmulas adjuntas corresponden a tres aminoácidos diferentes a pH 7 (neutro). Aclare el significado de los esquemas A, B y C, y de los grupos R, R− y R+. Escriba las fórmulas considerando estos valores: pH = 1 y pH = 13.
• La fórmula A corresponde a un aminoácido neutro, polar o apolar (R sin carga). La B es de un aminoácido ácido cuyo R− se debe a la presencia del grupo carboxilo disociado (COO−). La C es de un aminoácido básico cuyo R+ es consecuencia de la protonación del grupo amino (H3N+).
• 1ª consideración (pH = 1):
En los tres casos, a pH muy ácido el grupo COO− incorpora un protón (H+) y queda sin carga (COOH). Además, en el caso B, por la razón apuntada, se pierde la carga del grupo R.
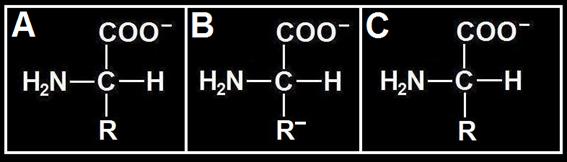
• 2ª consideración (pH = 13):
Si el pH es muy básico, el carboxilo está disociado (COO−) mientras que el grupo amino, presente también en el radical de C, cede un protón y queda sin la carga positiva.
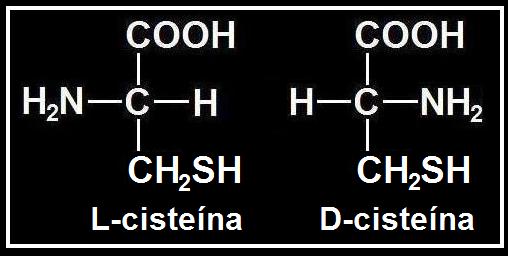
32.- (Consulte su libro). Aclare la diferencia entre cisteína y cistina. Escriba sus fórmulas. ¿Presentan actividad óptica ambos compuestos? Razone la respuesta.
• La cisteína es un aminoácido neutro polar cuyo grupo R es CH2SH. Su fórmula es:
• La cistina es un dímero que está formado por la unión de 2 cisteínas mediante un enlace o puente disulfuro (−S−S−):

La fórmula de la cistina depende de que las cisteínas integrantes sean de las formas L o D:
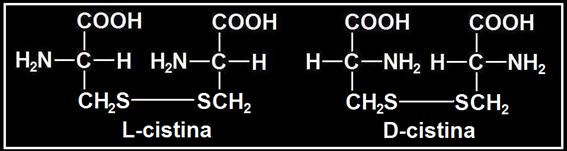
• Respecto a la actividad óptica, propiedad que se determina con un polarímetro, es condición necesaria la presencia de carbono asimétrico, circunstancia que se da en la D y L cisteína y en la D y L cistina, pero existe un caso de simetría molecular en la llamada forma "meso" de la cistina, integrada por una L-cisteína unida a D-cisteína, anulándose en tal caso la posibilidad de rotación óptica.
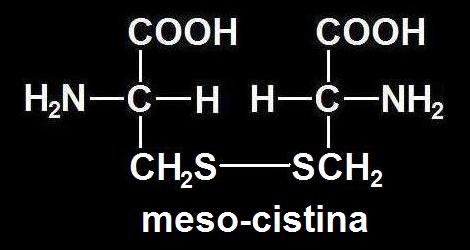
En conclusión: presentan poder rotatorio la L-cisteína, D-cisteína, L-cistina y D-cistina, pero la meso-cistina es ópticamente inactiva.
33.- ¿Qué son aminoácidos esenciales y semiesenciales? Cítelos.
Mediante la fotosíntesis las plantas son capaces de sintetizar los 20 aminoácidos proteinógenos a partir de compuestos inorgánicos, pero los animales y otros seres heterótrofos necesitan tomar algunos de esos 20 con la dieta al ser incapaces de sintetizarlos.
• Los aminoácidos esenciales son aquellos que no puede sintetizar un organismo y debe tomarlos con los alimentos. En la especie humana hay 8 que son esenciales: fenilalanina, isoleucina, leucina, lisina, metionina, treonina, triptófano, valina.
• Los aminoácidos semiesenciales son aquellos que, sin ser esenciales, pueden llegar a serlo en determinadas circunstancias, como la histidina, cisteína y tirosina en niños prematuros, y la arginina en situaciones de grandes requerimientos.
34.- Aclare el significado del término aminoaciduria.
El término aminoaciduria se refiere a la presencia de uno o más aminoácidos en la orina.
Algunas enfermedades relacionadas con el metabolismo de los aminoácidos originan una concentración anormalmente alta de uno o varios de ellos en la orina. Así, por ejemplo, en la fenilcetonuria se acumula fenilalanina, pues no puede transformarse en tirosina debido a que por una alteración genética no se produce la enzima necesaria (llamada hidroxilasa de la fenilalanina).
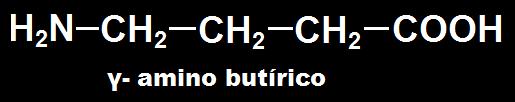
35.- ¿Qué son aminoácidos no proteinógenos? Escriba la fórmula de uno de ellos.
Son aquellos aminoácidos que no se encuentran formando parte de las proteínas. Por ejemplo: citrulina, ornitina, azaserina, ácido gamma amino butírico, etc.
Algunos de estos aminoácidos se originan en el metabolismo de los proteinógenos. Así, la ornitina se forma de la arginina en el ciclo de la urea, y el ácido γ-amino butírico es un neurotransmisor que se origina por descarboxilación del glutamato.
36.- Funciones biológicas los aminoácidos.
• Formación de péptidos y proteínas. Es la función más importante cuantitativamente.
• Neurotransmisión. Glutamato, glicina, γ-amino butírico.
• Formación de aminas especiales. De la histidina se forma la histamina; de la tirosina, la tiramina; del ácido glutámico, el gamma-amino butírico.
• Formación de compuestos nitrogenados diversos: carnitina, creatina, aminoazúcares, porfirinas, purinas, pirimidinas, melanina, tiroxina, etc.
• Energética. El catabolismo de los aminoácidos proporciona metabolitos intermediarios para el ciclo de Krebs y otras rutas metabólicas, lo que permite su utilización en procesos generadores de energía.