1.6. Enzimas.
1.6. Enzimas.
En general, todas las reacciones metabólicas están reguladas por las enzimas, unas proteínas globulares que actúan como catalizadores, aumentando la velocidad de aquellas reacciones que son energéticamente posibles. Las enzimas permiten las reacciones en las condiciones de temperatura, presión y pH propios del medio intracelular, reduciendo la energía de activación necesaria para que se produzca la reacción. Las enzimas no experimentan cambios estructurales al final del proceso químico que catalizan.
A mediados del siglo XIX, el científico francés Louis Pasteur estudiando la fermentación alcohólica descubrió las enzimas que denominó inicialmente fermentos. Pasteur creía que la actividad enzimática era inseparable de las células vivas, pero en el año 1897 Eduard y Hans Buchner consiguieron extraer y separar, sin que perdieran sucapacidad catalítica, las mismas enzimas de las correspondientes células. capacidad catalítica, las mismas enzimas de las correspondientes células.
A principios del siglo XX, E. Fisher observó la especificidad y en el año 1926 J. Summer obtuvo la primera enzima cristalizada y purificada, la ureasa.
1.6.1. Concepto y estructura.
Las/os enzimas son las proteínas más especializadas, como corresponde a su acción catalizadora de los procesos biológicos: degradación de nutrientes, transformaciones energéticas, síntesis de moléculas orgánicas, regulación de procesos metabólicos, etc.; incluso se mantienen activas fuera de la célula.
La mayoría de las reacciones celulares no se pueden producir espontáneamente a la velocidad adecuada, pues requerirían una elevada temperatura que sería letal para la célula, por la que es decisiva la acción enzimática para conseguir dicha velocidad de reacción.
Aunque hemos dicho que los enzimas son generalmente proteínas, existen otros enzimas de naturaleza ribonucleoprotéica, denominados ribozimas.
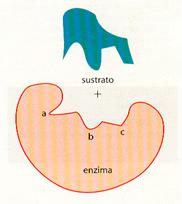
Las enzimas actúan sobre sustancias determinadas, conocidas como sustratos , cuya transformación hacen posible. En muchos casos el sustrato es una sustancia muy compleja que debe transformarse en otra u otras más simples; la enzima se une al sustrato a través de numerosas interacciones débiles como son: puentes de hidrógeno, electrostáticos, hidrófobos, etc., en un lugar específico, el centro activo o centro catalítico. Este centro es una pequeña porción del enzima constituido por una serie de aminoácidos que interaccionan específicamente con el sustrato debilitando los enlaces que mantienen unidos a los átomos que lo forman y haciendo más sencilla su transformación. Normalmente el centro activo del enzima es como una hendidura, que puede modificarse al unirse con el sustrato.
De los aminoácidos que constituyen las enzimas unos desempeñan una función estructura l, otros facilitan la unión enzima-sustrato, llamados de fijación y otros, los catalíticos, hacen posible la transformación del sustrato.
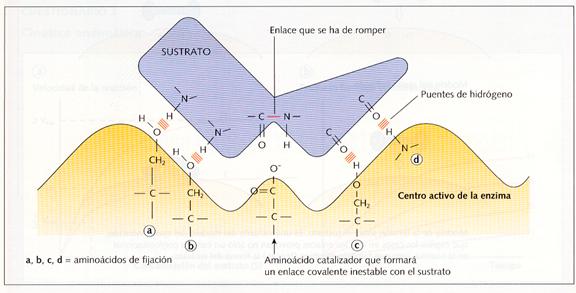
Unión de un sustrato con el centro activo de un enzima.
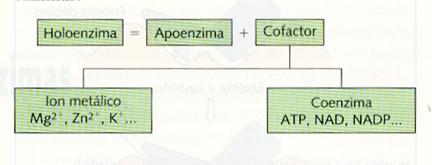
Las enzimas pueden realizar su función con los radicales de sus aminoácidos, otras necesitan además un componente no proteico llamado cofactor ; el conjunto enzima-cofactor se conoce como holoenzima. El cofactor es con frecuencia un ión metálico (Fe2+, Mg2+, etc.), en otros casos es un compuesto orgánico conocido como coenzima . Si el cofactor (ión metálico o coenzima) está unido mediante enlace covalente a la parte proteica (apoenzima) se le conoce como grupo prostético. Son varias las vitaminas que actúan como coenzimas, como se verá más adelante.
Las enzimas presentan algunas propiedades típicas:
- Son solubles en agua y difusibles en los líquidos orgánicos.
- Se requieren en dosis mínimas, ya que, como catalizadores que son, no sufren cambio en la reacción.
- Tienen gran actividad, pudiendo transformar un sustrato de masa molecular mucho mayor que ellas.
- Hacen que las transformaciones se produzcan a gran velocidad.
- Disminuyen la energía de activación y permiten que la reacción se realice a menor temperatura.
- Son sustancias muy específicas, no actúan sobre cualquier sustrato.
- Se alteran por acción del calor, cambios de pH, radiaciones, etc., como todas las proteínas.
Especificidad. De entre las propiedades de las enzimas merece un comentario la especificidad. La especificidad enzimática se refiere a la capacidad de cada enzima para diferenciar sustancias que tienen características semejantes (especificidad de sustrato) o para realizar una transformación concreta (especificidad de acción). La especificidad de sustrato es absoluta cuando un enzima sólo puede catalizar la transformación de una sustancia (en algunos casos sólo puede unirse a uno de los isómeros D o L de una misma sustancia, pero no a los dos); se habla de especificidad de grupo cuando una misma enzima puede catalizar la transformación de un grupo de sustancias que tienen un tipo de enlace determinado (por ejemplo, la α-glucosidasa tiene acceso a glúcidos con enlace α), o que son portadoras de determinado grupo (las fosfatasas separan los grupos fosfatos de cualquier tipo de molécula).
1.6.2. Mecanismo de acción y cinética enzimática.
MECANISMO DE ACCIÓN.
Cualquier reacción química se inicia con la rotura de ciertos enlaces entre los átomos que constituyen las moléculas de los reactivos para formar, posteriormente, los nuevos enlaces que originan las moléculas de los productos. Ese estado en el que los enlaces de los reactivos están debilitados o rotos, aún no se han formado los nuevos, se conoce como estado de transición o estado activado.
Para alcanzar el estado de transición y, en definitiva, para que la reacción química tenga lugar, es preciso comunicar a los reactivos cierta cantidad de energía, denominada energía de activación . Esto ocurre tanto en las reacciones endotérmicas como en las exotérmicas.
En las llamadas reacciones espontáneas, la energía de activación es tan baja que se obtiene de la propia energía cinética de las moléculas o incluso de la luz que incide en el lugar de reacción. En las reacciones no espontáneas, sin embargo, esta energía es tan alta que no se producen si no se aplica calor.
La acción catalizadora de las enzimas consiste en rebajar la energía de activación para llegar fácilmente al estado de transición y permitir que la reacción se lleve a cabo. En definitiva, sin la presencia del catalizador no es posible alcanzar el estado de transición espontáneamente, y con él, sí es posible.
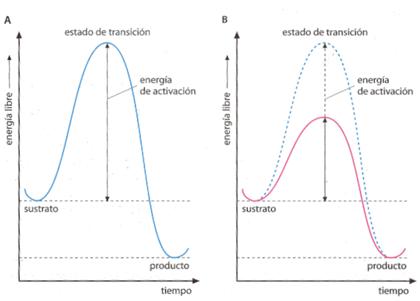
Perfil de energía libre en una reacción sin catalizar (A) y comparación con el efecto de un catalizador (B)
Las enzimas aceleran las reacciones disminuyendo la energía de activación.
Los catalizadores realizan su acción favoreciendo la aproximación de moléculas de los reactivos, pero como no actúan como tales, no se consumen. Únicamente ayudan a que se produzca la reacción.
Todas las reacciones metabólicas (salvo alguna excepción) son reacciones catalizadas por enzimas.
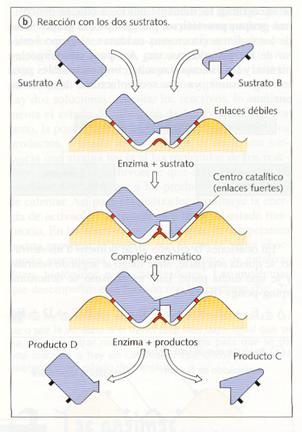
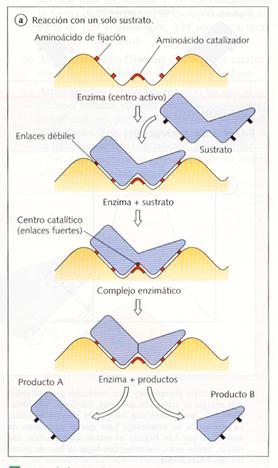
Cuando un sustrato se encuentra con la enzima correspondiente, la reacción catalizada se produce en tres etapas:
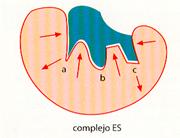
1. En primer lugar, el sustrato se une a la apoenzima formando el complejo enzima-sustrato (ES). Como ya se ha apuntado, esta unión se caracteriza por un alto grado de especificidad, de modo que para cada tipo de sustrato y de reacción se necesita una enzima concreta.
La especificidad enzimática se debe a la estructura proteica de la apoenzima, la cual presenta una zona, denominada centro activo, con una forma espacial característica en la que se acopla el sustrato. Este acoplamiento se ha comparado con el que existe entre una llave y su cerradura: sólo es posible abrirla si los salientes y entrantes de una y otra encajan exactamente, por lo que cualquier cambio que se produzca en la forma impedirá su acoplamiento.
La teoría de la «llave~cerradura», propuesta en 1890 por Emil Fischer, se considera esencialmente correcta, aunque en la actualidad se ha probado que en algunas enzimas el centro activo es capaz de modificar su forma para adaptarse al sustrato, de ahí que a este proceso, postulado por Daniel E. Koshland Jr. en 1958, se le denomine de «ajuste o acoplamiento inducido». Sería algo semejante a la introducción de una mano en un guante. La propia mano (que en esta comparación equivaldría al sustrato) hace que el guante (equivalente al centro activo de la enzima) se adapte mejor cuando se introduce en él.
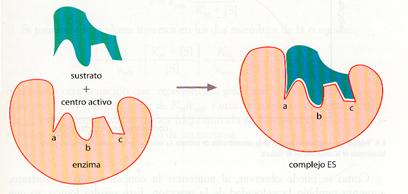
Modelo de la llave-cerradura.
El centro activo de la enzima posee, por sí mismo, una forma complementaria a la del sustrato
|
|
|
|
Modelo de ajuste inducido.
El centro activo de la enzima, se adapta a la forma del sustrato.
Los radicales de los aminoácidos del centro activo se unen al sustrato y consiguen debilitar sus enlaces provocando cambios energéticos que permiten alcanzar el estado de transición.
La unión es reversible, pues una parte del complejo enzima-sustrato (ES) se disocia.
E+S « ES
Debido precisamente a esa reversibilidad, esta primera etapa es la más lenta.
2. Una vez formado el complejo enzima-sustrato, el cofactor lleva a cabo la reacción y se obtiene el producto final (P). Esta etapa es muy rápida e irreversible.
ES « E+P
En el caso de que no existan cofactores, la acción catalítica la realizan algunos aminoácidos del propio centro activo.
3. El producto se libera del centro activo y la apoenzima queda libre para volver a unirse a nuevas moléculas de sustrato.
|
|
|
Actividad enzimática.
CINÉTICA ENZIMÁTICA.
Si se representa gráficamente la velocidad con que aparece el producto (moles del producto que se forman por unidad de tiempo) de una determinada reacción enzimática, en función de la concentración de sustrato inicial, para una cantidad constante de enzima, se obtiene una gráfica del siguiente tipo:
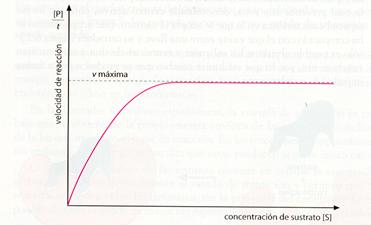
Velocidad de reacción en función de la concentración de sustrato.
La velocidad de la reacción catalizada depende inicialmente de la concentración de sustrato
Como se puede observar, al aumentar la concentración de sustrato, aumenta también la velocidad de la reacción. Esto resulta lógico, ya que mientras existe enzima libre, a mayor número de moléculas de sustrato, más moléculas de producto aparecerán. Pero llega un momento en que, a pesar de que la concentración de sustrato sigue aumentando, la velocidad no varía. Se alcanza una velocidad máxima que no es posible superar. Esta situación corresponde a la inexistencia de moléculas de enzima libres, pues todas están ocupadas por moléculas de sustrato formando complejos ES. A medida que se forman las moléculas de producto, las enzimas van liberándose y pueden aceptar nuevas moléculas de sustrato que están «a la espera».
En la reacción enzimática, la etapa limitante, es decir, la más lenta, corresponde a la unión del sustrato al centro activo para formar el complejo ES, pues, como se ha visto, es un proceso reversible. Existe, por tanto, una constante de equilibrio (Ke)para esta etapa.
[E] [S]
Ke = ---------------------
[ES]
Para calcular dicha constante, es preciso conocer la concentración de enzima libre y la concentración de enzima que forma el complejo ES, valores que no se pueden establecer directamente. Sin embargo, cuando la velocidad de la reacción es la mitad de la máxima, el número de moléculas de enzima libres es igual al de enzimas ocupadas, es decir:
[E] = [ES]
La expresión de la constante de equilibrio en esta situación se simplifica y queda:
Ke = [S]
La constante así obtenida se denomina de Michaelis-Menten o KM y se define como la concentración de sustrato para la cual la reacción alcanza la velocidad semimáxima.
La KM es característica de cada enzima y cuanto menor sea su valor, mayor afinidad tendrá la enzima por el sustrato, ya que se alcanza antes la velocidad semimáxima.
La KM se puede calcular fácilmente. Basta con ver en la gráfica de la velocidad respecto a la concentración de sustrato cuál es el valor de éste para el que se alcanza la velocidad semimáxima.
Del grado de afinidad, relacionado con la KM, depende la velocidad de la enzima.
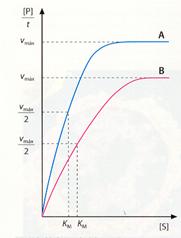
Velocidades semimáximas y KM
En 1913, Leonor Michaelis y Maud Menten dedujeron una ecuación que también lleva su nombre, que permite calcular la velocidad de una reacción enzimática para cualquier concentración de sustrato, utilizando el valor de KM y de la velocidad máxima.
[S]
v = vmax × --------------------
KM + [S]
Si tomamos los valores inversos en los dos miembros de la ecuación:
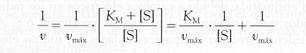
obtenemos otra ecuación que, representada gráficamente, corresponde a una línea recta con una pendiente de KM / Vmáx y una ordenada en el origen igual a 1 / Vmáx. Esta representación gráfica (denominada de Lineweaver-Burk) resulta muy útil para el estudio cinético de las enzimas.
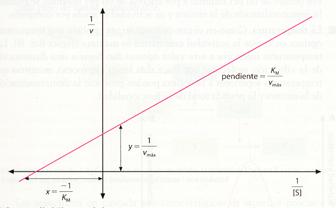
Representación de Lineweaver-Burk
En las células, la mayoría de las enzimas no están habitualmente saturadas de sustrato; por eso, pese a ser muy eficaces, la velocidad de las reacciones que catalizan está alejada de la velocidad máxima. En estas condiciones, la velocidad de la reacción viene condicionada, sobre todo, por la velocidad a la que las enzimas encuentren sus sustratos en la disolución, controlada por la difusión. Por ello, para acelerar más las reacciones es frecuente que las enzimas se asocien formando complejos multienzienzi máticos o que se sitúen dentro de la célula en compartimentos más pequeños, muchas veces asociados a las membranas celulares. Así, por difusión, el producto de reacción de una enzima tiene más probabilidades de encontrar la siguiente enzima.
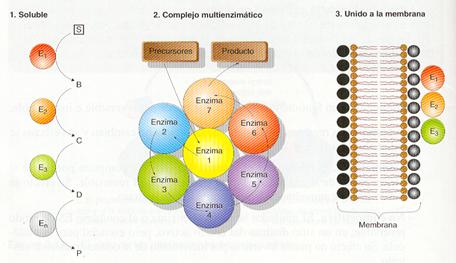
Tipos de sistemas multienzimáticos.
1.6.3. Regulación de la actividad enzimática: temperatura, pH, inhibidores.
Las reacciones enzimáticas constituyen la clave de la actividad vital de una célula. Esta actividad, sin embargo, no es siempre la misma. En un momento dado, por ejemplo, puede interesar aumentar la síntesis de un determinado producto, y en otro, metabolizar un sustrato que acaba de aparecer, por lo que se deberá aumentar la actividad de las enzimas implicadas en uno u otro proceso. Por otro lado, una vez conseguida la cantidad precisa del producto, la actividad enzimática debe disminuir o anularse para evitar un gasto inútil.
En definitiva, las necesidades celulares son cambiantes y, por tanto, la velocidad de las reacciones enzimáticas debe variar de acuerdo con ellas. Es imprescindible, pues, una regulación de la actividad enzimática que cumpla, en cualquier caso, el principio de economía celular por el que solamente permanecen activas las enzimas precisas en cada momento, evitando de este modo la fabricación innecesaria de productos, cuya acumulación, además, podría tener efectos negativos.
Los cambios de pH y temperatura influyen en la velocidad de las reacciones enzimáticas, pero habitualmente estos valores no cambian en un organismo vivo, por lo que se utilizan otros mecanismos de regulación, como la activación y la inhibición enzimáticas y el alosterismo.
Temperatura.
El aumento de la temperatura provoca en las moléculas un incremento de su energía cinética, los movimientos de las mismas son más rápidos, y la frecuencia de las colisiones entre moléculas aumenta, lo que propicia una mayor velocidad de reacción. Se ha comprobado que un aumento de 10 °C puede llegar a duplicar, y en ciertos casos a cuadruplicar, la velocidad de una reacción.
Aunque esta característica solamente es aplicable a las reacciones catalizadas por las enzimas hasta una temperatura «crítica», que coincide con la temperatura óptima, en la que la velocidad de la reacción catalizada por una determinada enzima es máxima.
A partir de esta temperatura óptima se produce un brusco descenso de la velocidad de reacción, hecho que a la luz de nuestros conocimientos tiene fácil explicación.
Recordemos nuevamente que las enzimas son proteínas, moléculas frágiles, sensibles, y que a altas temperaturas sufren lo que conocemos como su desnaturalización, y que una enzima desnaturalizada, es decir, en la que sólo se mantiene su estructura primaria, no tiene capacidad para catalizar una reacción metabólica.
En general, la temperatura crítica de las enzimas oscila entre los 55 y los 60 °C, aunque las enzimas de algunas bacterias, que viven en aguas termales, llegan a tener temperaturas críticas de 80 a 87 °C.
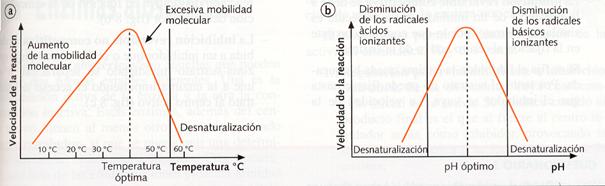
Regulación de la actividad enzimática
a) Variación de la velocidad de reacción b) Variación de la actividad de la enzima con el pH
catalizada por un enzima con la temperatura
pH.
Cada enzima necesita unos valores límites (máximos y mínimos) para poder desarrollar su actividad. Traspasados estos valores, la enzima se desnaturaliza y pierde su actividad. Dentro de estos límites existe, como en el caso de la temperatura, un valor determinado del pH, en el que la enzima desarrolla su actividad máxima, valor al que se le da el nombre de pH óptimo, y que varía de unas enzimas a otras. Así, la pepsina del jugo gástrico posee un pHóptimo de 2, muy ácido, mientas que el pH óptimo de tripsina presente en el jugo pancreático es de 7,8, ligeramente básico.
La mayoría de las enzimas intracelulares poseen, sin embargo, un pH óptimo cercano a la neutralidad.
Activación enzimática.
La presencia de activadores permite que ciertas enzimas que se mantenían inactivas lleven a cabo su acción, es decir, se activen. Normalmente, la unión del activador hace que el centro activo adquiera la estructura adecuada para el acoplamiento del sustrato. Algunos cationes, como Mg2+ o Ca2+ desempeñan un papel importante como activadores enzimáticos.
También pueden actuar como activadores diversas moléculas orgánicas, incluso el propio sustrato. Este último es un caso muy interesante y frecuente. La enzima permanece inactiva hasta que aparece el sustrato; es decir, si no hay sustrato, no es necesaria la actividad de la enzima correspondiente, pero si lo hay, se produce la activación para que ese sustrato lleve a cabo la reacción, es decir, el sustrato activa su propia metabolización.
Inhibidores.
Los inhibidores son sustancias que disminuyen la actividad de una enzima o bien impiden completamente la actuación de la misma. Pueden ser perjudiciales o beneficiosos como, por ejemplo, la penicilina, que es un inhibidor de las enzimas que regulan la síntesis de la pared bacteriana, por lo que es útil contra las infecciones bacterianas, y el AZT, que es un inhibidor de la transcriptasa inversa, por lo que retrasa el desarrollo del SIDA.
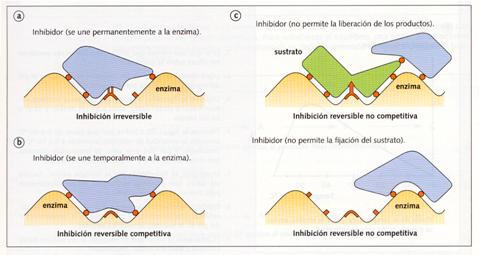
La inhibición puede ser de dos tipos: irreversible y reversible.
· La inhibición irreversible, o envenenamiento de la enzima, tiene lugar cuando el inhibidor o veneno se fija permanentemente al centro activo de la enzima alterando su estructura y, por tanto, inutilizándolo.
· La inhibición reversible tiene lugar cuando no se inutiliza el centro activo, sino que sólo se impide temporalmente su normal funcionamiento. Existen dos modalidades: competitivay no competitiva.
- La inhibición reversible competitiva se debe a la presencia de un inhibidor cuya molécula es similar al sustrato, por lo que compite con éste en la fijación al centro activo de la enzima.
Si se fija el inhibidor, la enzima queda bloqueada. Por tanto el sustrato no puede fijarse hasta que el inhibidor se vaya. La velocidad de la reacción disminuye en función de la concentración del inhibidor.
- La inhibición reversibleno competitiva es debida a un inhibidor que o se fija al complejo enzima-sustrato impidiendo su separación, o une a la enzima impidiendo el acceso del sustrato al centro activo.
Tipos de inhibición.
Enzimas alostéricos o reguladores.
Uno de los mecanismos de regulación de las reacciones químicas de las células se basa en que los enzimas pueden presentar dos conformaciones distintas. Estos enzimas se denominan alostéricos (del griego allo = otro, stereo = espacio) o reguladores y poseen más de un centro (espacio) de actividad: el centro activo, por el que se une al sustrato y el centro alostérico, por el que se une a un efector o modulador.
El efector puede ser un inhibidor denominado modulador negativo o bien un activador o modulador positivo, que provocan el cambio de conformación del enzima. En un mismo enzima puede haber uno o varios centros reguladores que se unen a moduladores diferentes
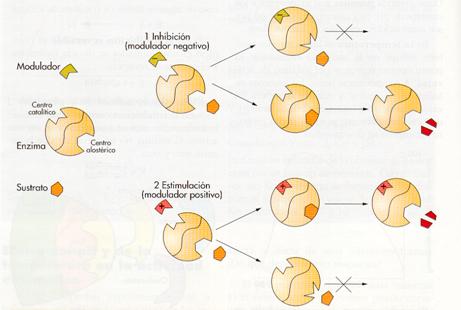
Acción de los enzimas alostéricos.
Los enzimas alostéricos poseen dos características que los distinguen del resto de los enzimas:
a) En general, los enzimas alostéricos poseen más de una cadena polipeptídica, por tanto, presentan estructura cuaternaria con dos o más subunidades.
b) La cinética de estos enzimas no es hiperbólica, sino sigmoidea, es decir, que por la interacción de otras moléculas, el aumento inicial de la concentración del sustrato provoca un menor incremento en la velocidad de reacción.
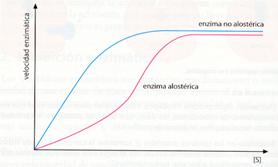
El modelo alostérico explica el modo de inhibición por producto final,feed-back oretroinhibición. En una cadena de reacciones, el producto final puede ser un modulador negativo del enzima que cataliza la primera etapa.
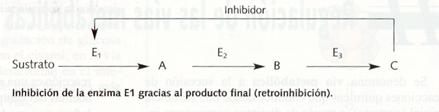
El resultado de este proceso es que se mantiene la cantidad de P dentro de unos límites, puesto que si hay mucho, un mayor número de moléculas del enzima (E1) se unen a él y no al sustrato, con lo cual se sintetiza menos P. Cuando la concentración de p disminuye, más moléculas de enzima aceptan sustrato y se producirá más síntesis de P.
Otro modo de autorregulación que permite el alosterismo es por inducción enzimática, se da en enzimas cuya conformación inicial es la inactiva.

Otros mecanismos de regulación se deben a enzimas que presentan formas activas o inactivas por modificaciones covalentes reversibles. Otra forma especial de regulación son losisoenzimas enzimas distintos que catalizan la misma reacción y que pueden tener distinta afinidad por el sustrato.
CLASIFICACIÓN DE LAS ENZIMAS
Se conocen alrededor de 2000 enzimas. Para nombrarlas se emplea un término que alude al sustrato y al tipo de reacción catalizada, al que se añade la terminación -asa. Por ejemplo, la aspartato transaminasa es una enzima que lleva a cabo la reacción de transferencia de un grupo amino desde el ácido aspártico al ácido pirúvico.
La nomenclatura recomendada por la Comisión Internacional de Enzimas (IEC), organismo que cataloga las enzimas conocidas, consiste en un código de cuatro números que hacen referencia a la clase en que está incluida, a la subclase, a la subdivisión y a la enzima concreta de que se trate. Aunque más precisa, esta nomenclatura no resulta cómoda y se utiliza con menos frecuencia que la anterior.
Según el tipo de reacción que catalizan, las enzimas se clasifican en seis clases como se muestra en el cuadro siguiente: