1.5. Proteínas.
1.5. Proteínas.
Entre las propiedades de los seres vivos destaca su capacidad de replicarse, para lo que requieren una descripción completa de sí mismos, un conjunto de instrucciones que especifique cada función del organismo. ¿Dónde se almacena esa información? Las únicas moléculas capaces de contenerla son las proteínas (en su secuencia de aminoácidos) y los ácidos nucleicos (en su secuencia de nucleótidos). Cuando Mulder, en 1839, investigaba las albúminas, Berzelius, uno de los fundadores de la química moderna, le sugirió la denominación de proteínas (del griego proteios, «primario»), ya que consideraba que podrían ser las moléculas biológicas más importantes. Efectivamente, desde entonces se ha comprobado que están implicadas en todos los procesos celulares y realizan un enorme número de funciones biológicas, aunque es otra molécula, el ADN (descubierto por Miëscher en 1869), la que almacena la información genética.
Existe una enorme cantidad de proteínas con propiedades y funciones muy diferentes, capaces de ejecutar la información sobre el funcionamiento celular que está contenida en los ácidos nucleicos.
Las proteínas y los ácidos nucleicos contienen también información sobre la historia y los mecanismos evolutivos de las especies.
1.5.1. Concepto e importancia biológica.
Las proteínas son macromoléculas orgánicas compuestas básicamente por carbono, hidrógeno, oxígeno y nitrógeno; además, es frecuente el azufre y en menor frecuencia fósforo, hierro, magnesio, cobre, etc.
Se pueden definir como polímeros de unas moléculas llamadas aminoácidos, aunque para que se les llame proteínas deben tener más de 50 moléculas de aminoácido o un peso molecular superior a 5.000.
Se pueden destacar las siguientes características:
- son compuestos de elevado peso molecular,
- forman más del 50 % en peso de la materia viva una vez seca,
- son fundamentales para la estructura y el funcionamiento celular. En una sola célula puede haber miles de proteínas diferentes,
- desempeñan funciones muy diversas dentro de las células,
- son específicas, diferentes en las especies e incluso en individuos de la misma especie,
- básicamente están formadas por 20 α-aminoácidos, unidos por enlaces peptídicos, y
- son la expresión de la información genética de la célula.
La importancia de estos compuestos radica en que son los responsables de la mayor parte de las estructuras y de las acciones vitales de los organismos.
Se pueden hacer diversas clasificaciones de las proteínas; a partir de su composición se pueden hacer dos grupos: simples u holoproteinas, formadas únicamente por aminoácidos y conjugadas oheteroproteinas, con una parte proteica formada por aminoácidos y otra no proteica llamada grupo prostético.
Clasificación de las proteínas.

1.5.2. Aminoácidos. Enlace peptídico.
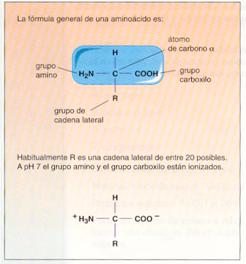
Un aminoácido que forma parte de una proteína es un compuesto orgánico pequeño, con un grupo amino (-NH2), un átomo de hidrógeno (-H) y un grupo ácido o carboxilo (-COOH), unidos covalentemente a un carbono central, que por ser el siguiente al extremo del grupo ácido se conoce como carbono α La cuarta valencia de ese carbono lleva un grupo lateral o grupo R (de radical) que varía en los distintos aminoácidos.
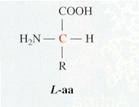
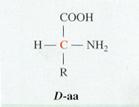
Excepto en la glicina, en la que el grupo lateral es un átomo de hidrógeno, en los demás aminoácidos el carbono α es asimétrico y, por ello, para cada aminoácido puede haber dos enantiómeros D y L. En todas las proteínas hay sólo L aminoácidos, aunque podemos encontrar D aminoácidos en las paredes celulares bacterianas.
|
|
|
Formula general de un D y un L aminoácido
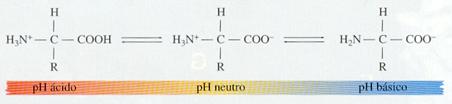
Los aminoácidos son anfóteros , es decir, pueden actuar como ácidos y como bases, dependiendo del pH. Cualquier aminoácido a pH neutro contiene, al menos, la carga negativa del grupo ácido (se disocia y suelta un protón al agua) y la carga positiva del grupo amino (capta un protón del agua). Si el pH se vuelve muy ácido, el grupo ácido incorpora un protón y desaparece la carga negativa. Si el pH se vuelve muy básico, el grupo amino cede un protón y desaparece la carga positiva.
Carácter anfótero de los aminoácidos
Los aminoácidos que no puede sintetizar un organismo se llaman esenciales , y deben ser incorporados con la dieta. En la especie humana hay ocho aminoácidos esenciales. Los aminoácidos son compuestos sólidos, cristalinos, de elevado punto de fusión, solubles en agua y muestran actividad óptica.
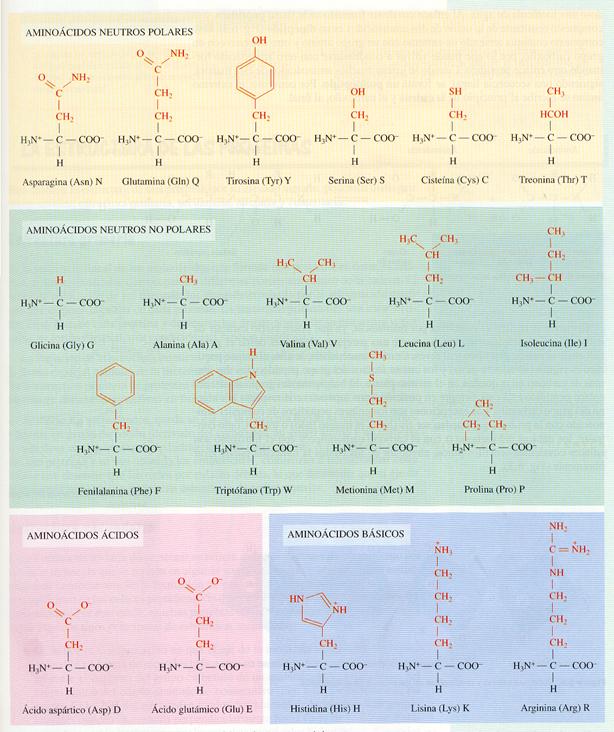
Los aminoácidos se clasifican atendiendo a las características de su grupo radical, según su ionización, polaridad y reactividad, en:
· Neutros polares, cuando el grupo R contiene enlaces covalentes polares, porlo que, aunque no tienen carga eléctrica neta, tienen afinidad por el agua.
· Neutros no polares, cuando el grupo R sólo contiene enlaces covalentes apolares que lo hacen muy hidrofóbico. Pueden ser alifáticos o aromáticos.
· Ácidos, cuando el grupo R lleva un grupo ácido, de manera que a pH neutro, tienen carga eléctrica negativa neta.
· Básicos, cuando el grupo R lleva un grupo básico (amino), de tal modo que a pH neutro, tienen carga eléctrica positiva neta.
Formulas de los 20 aminoácidos agrupados según sus características.
EL ENLACE PEPTIDICO.
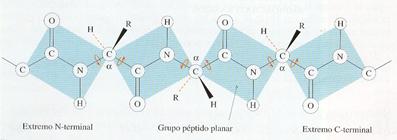
Los aminoácidos se unen por reacciones de condensación en las que el grupo amino de uno de ellos se une con el grupo carboxilo de otro formando una amida y liberándose una molécula de agua. Al enlace covalente formado se le llama peptídico , y el compuesto resultante de la unión de dos aminoácidos es un dipéptido. Este compuesto continúa teniendo un extremo con un grupo amino y otro extremo con un grupo carboxilo, por lo que puede volver a condensarse con otro aminoácido formando otro enlace peptídico. Cuando se juntan muchos aminoácidos de esta manera, siguiendo una secuencia lineal, se forma un polipéptido. Por convenio, el extremo amino se escribe al principio de la cadena y el carboxilo, al final.
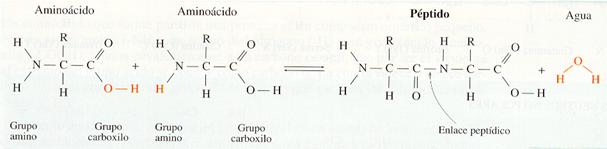
Formación del enlace peptídico.
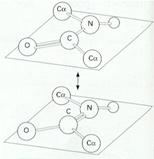
El enlace peptídico se estabiliza por resonancia, ya que posee cierto carácter de doble enlace, al desplazarse continuamente una pareja de electrones desde el grupo carbonilo al enlace peptídico y al revés. Como consecuencia de ello, el enlace peptídico es rígido (no admite giros) y los cuatro átomos del grupo péptido y los dos átomos de carbono en α quedan en el mismo plano. El hidrógeno del grupo amino del enlace peptídico está casi siempre en posición trans (opuesta) con respecto al oxígeno del grupo carbonilo. Las excepciones son los enlaces peptídicos de cualquier aminoácido con la prolina, que pueden ser cis (hacia el mismo lado) o trans. Como contraste, los enlaces del carbono a con el carbono carbonílico y con el nitrógeno son enlaces covalentes sencillos puros, alrededor de los cuales la molécula puede girar libremente.
|
|
|
|
Resonancia del enlace peptídico. |
Rotaciones libres y restringidas en los enlaces de polipéptidos. |
Cuando se forma el enlace peptídico desaparecen las cargas eléctricas de los grupos carboxilo y amino que participan en el enlace. Sin embargo, los grupos laterales de los aminoácidos de la cadena polipeptídica pueden llevar cargas eléctricas si incluyen grupos ácidos o básicos.
Para cada proteína existe un pH llamado punto isoeléctrico, en el que la carga eléctrica neta es cero.
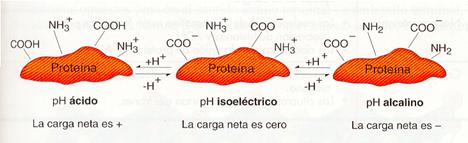
Explicación del punto isoeléctrico de una proteína.
1.5.3. Estructura de las proteínas.
Para analizar la estructura de una proteína, por su elevado tamaño, podemos distinguir varios niveles: estructura primaria, secundaria, terciaria y cuaternaria.
ESTRUCTURA PRIMARIA
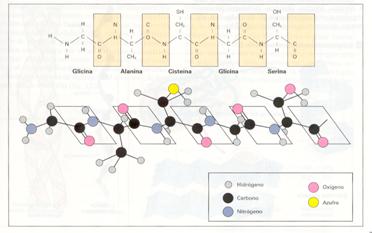
Es la secuencia lineal de los aminoácidos que forman una proteína, es decir, la relación de los aminoácidos que ocupan las diferentes posiciones dentro de la cadena. El orden de colocación de los aminoácidos viene determinado por la información genética que dispone la célula de cada proteína. La secuencia primaria es una característica específica de cada proteína y determina los demás niveles de su estructura y, por tanto, su forma espacial, que condiciona su función biológica.
La variación de la estructura primaria, por pequeña que sea, puede alterar o destruir la forma espacial habitual de la proteína y, por consiguiente, su función. Comparando la estructura primaria de proteínas homólogas de diferentes organismos podemos establecer distancias evolutivas en función del número de aminoácidos que varían.
Al unirse los aminoácidos, queda un eje de la molécula donde se repiten monótonamente un grupo carbonilo (derivado del carboxilo), un grupo amino y un carbono que lleva unidos un átomo de hidrógeno y un grupo lateral. A medida que se forma una proteína y se van uniendo los aminoácidos, comienzan a interaccionar entre ellos y con el medio que los rodea por enlaces débiles, lo que determina que el eje de molécula se pliegue y aparezcan estructuras de orden superior.
Estructura primaria de una proteína.
ESTRUCTURA SECUNDARIA
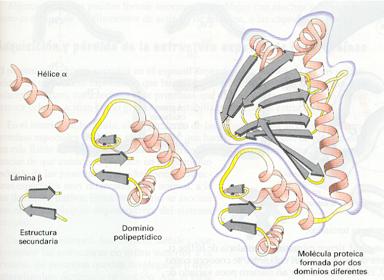
La estructura secundaria de proteínas se refiere a ciertos patrones de plegamiento del eje de la molécula que se repiten en algunas zonas de muchas proteínas. Estas estructuras son consecuencia de la formación de puentes de hidrógeno entre los átomos que participan en los enlaces peptídicos, sin que intervengan los grupos laterales de los aminoácidos. Por esta razón, muchas proteínas diferentes pueden formar estas estructuras. Hay dos tipos principales de estructuras secundarias:
· La hélice α, conformación en que el eje de la molécula adopta una estructura ordenada en forma de espiral o hélice que se mantiene por puentes de hidrogeno entre el oxígeno del grupo carbonilo de un aminoácido y el hidrógeno del grupo amino del cuarto aminoácido consecutivo. De esta forma, los grupos CO y NH del eje quedan unidos por puentes de hidrógeno. Los grupos laterales quedan extendidos perpendicularmente hacia fuera de la hélice. Estas estructuras están hechas principalmente de aminoácidos hidrofóbicos. Como los puentes de hidrógeno se pueden romper y volver a formarse, las proteínas helicoidales o las partes helicoidales de las proteínas tienen cierta elasticidad y se suelen disponer en zonas que no están en contacto con el agua, por ejemplo, en las membranas, ya que las moléculas de agua distorsionan la estructura de la hélice. Por convenio se suele representar esquemáticamente mediante cintas helicoidales.
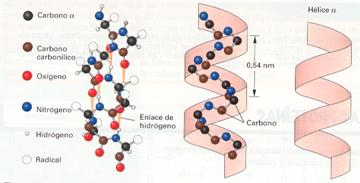
Esquema de una hélice "α"
· La lámina u hoja b plegada es una conformación en la que dos o más segmentos de la cadena polipeptídica se mantienen paralelos, extendidos, mediante puentes de hidrógeno entre los átomos de los enlaces peptídicos. Los pliegues de cada uno de los segmentos son debidos a la ordenación en zig-zag de los átomos del eje de la molécula. Los grupos laterales de los aminoácidos quedan saliendo alternativamente hacia arriba y hacia abajo de los pliegues de la lámina. Los segmentos que interaccionan pueden estar orientados en la misma dirección (cadenas paralelas) o en direcciones contrarias (cadenas antiparalelas). Esta estructura determina que la molécula quede lisa y deformable, aunque no elástica. Por convenio se suele representar esquemáticamente mediante flechas anchas.
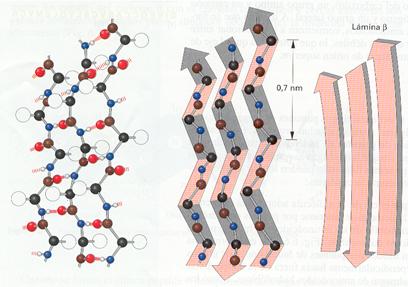
Esquema de una lámina "b"
· Cuando el eje no toma una disposición regular fácilmente definible hablamos de cadena estadística o de enrollamiento alazar. Por convenio se suele representar esquemáticamente mediante una línea delgada.
Generalmente, en una misma cadena polipeptídica hay regiones de hélice α, de hoja b y de enrollamiento al azar.
Un dominio proteico es una parte de una cadena polipeptídica que puede plegarse independientemente del resto, dando lugar a una estructura espacial característica. Muchas proteínas grandes constan de varios dominios unidos por segmentos desestructurados de cadena polipeptídica. Cada dominio suele estar asociado a una función de la proteína. Muchas proteínas pueden agruparse en familias proteicas que comparten dominios estructurales asociados a una función determinada.
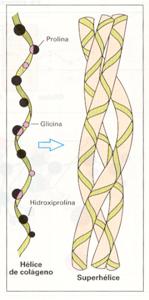
Normalmente, una hélice α aislada no es estable por sí sola en un medio acuoso. El carácter hidrofóbico de las hélices α favorece que puedan interaccionar entre sí dos de estas estructuras, enrollándose una sobre otra, con lo que se forma una superhélice o hélice sobreenrollada. Los grupos laterales hidrófobos quedan hacia el interior de la superhélice. Esta estructura se encuentra en la proteína queratina.
Un caso especial es el de la molécula de colágeno, la proteína típica de los tejidos conectivos, formada por tres cadenas polipeptídicas ricas en el aminoácido prolina y con el aminoácido glicina cada tres residuos. Las tres cadenas se enrollan entre sí generando una triple hélice muy empaquetada, con aspecto de cable , gracias al pequeño tamaño de los grupos laterales de la glicina. Estas moléculas se ordenan luego formando grupos de fibrillas largas y finas, extraordinariamente resistentes, que mantienen los tejidos unidos.
|
|
|
|
Estructura del cable de colágeno |
Relación entre dominios y otros niveles de estructura. |
ESTRUCTURA TERCIARIA.
La estructura terciaria de proteínas se refiere al aspecto tridimensional global de la macromolécula. Es consecuencia de las interacciones entre aminoácidos que pueden quedar muy alejados en la estructura primaria y de los dobleces que introduce algún aminoácido, como la prolina, por su rigidez, en el eje de la molécula. Por regla general, los grupos laterales polares de los aminoácidos tienden a colocarse en la superficie de la molécula formando puentes de hidrógeno con el agua, mientras que los aminoácidos no polares permanecen en el interior. Las interacciones tienen lugar entre los grupos laterales de los aminoácidos y pueden ser de varios tipos:
a) Atracciones o repulsiones entre los aminoácidos con grupos laterales polares, que se manifiestan en la formación de puentes de hidrógeno .
b) Atracciones o repulsiones entre los aminoácidos con grupos laterales iónicos (ácidos y bases), que forman enlaces iónicos, llamados a veces puentes salinos .
c) Repulsiones entre los grupos laterales apolares y el agua, que se manifiestan en las interacciones hidrofóbicas y en las fuerzas de Van der Waals.
d) Los grupos laterales que contienen el grupo -SH del aminoácido cisteína pueden formar enlaces covalentes entre sí, cuando se oxidan, dando lugar a un enlace covalente (-S-S-): es el llamado puente disulfuro .
- SH + SH - D D - S – S - + H2
Mientras que los puentes de hidrógeno y los salinos se inestabilizan a altas temperaturas, las interacciones hidrofóbicas son más estables.
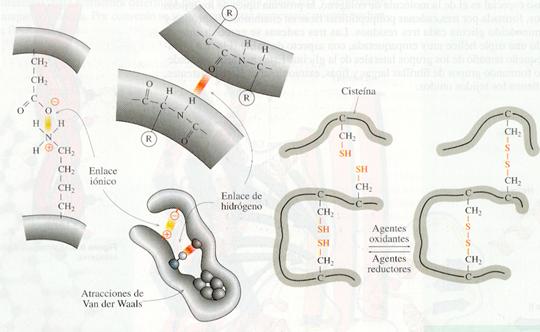
Tipos de enlaces débiles y covalentes de la estructura terciaria
Hay dos tipos principales de estructuras terciarias:
- Las proteínas que, en toda su longitud, tienen estructura secundaria de hélice a, de hoja b, o que tienen estructura de cable, como el colágeno, se conocen como proteínas fibrosas. En general, están formadas por un número poco variado de aminoácidos, en una secuencia repetitiva. Tienen funciones estructurales.
- Las proteínas que tienen formas compactas, no necesariamente esféricas, son las proteínas globulares. Suelen mostrar secuencias complicadas de aminoácidos sin ningún esquema de repetición. Son formas típicas de las enzimas, proteínas que catalizan las reacciones del metabolismo, de los anticuerpos y de los receptores.
ESTRUCTURA CUATERNARIA.
Este nivel de estructura sólo está presente en proteínas formadas por más de una cadena polipeptídica. Cada una de las cadenas se llama subunidad de la proteína o protómero. Las subunidades pueden ser iguales o distintas. La estructura cuaternaria se refiere a la estructura espacial global de toda la proteína, consecuencia de las interacciones y organización en el espacio de las diferentes subunidades. El tipo de interacciones que se producen son análogas a las descritas en la estructura terciaria.
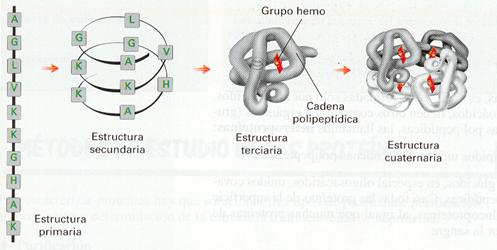
Niveles de organización de la hemoglobina.
Algunas proteínas pueden formar enormes ensamblajes con muchas subunidades, como es el caso de los filamentos de actina o de tubulina, o las cápsidas de los virus.
ADQUISICION Y PÉRDIDA DE LA ESTRUCTURA ESPACIAL DE LAS PROTEINAS.
El plegamiento de una proteína en el espacio depende de la secuencia de sus amino- ácidos. Es un proceso espontáneo que busca la confomlaci6n de menor energía. Los enlaces disulfuro, característicos de proteínas que van a ponerse en contacto con el exterior celular, actúan como grapas para estabilizar aún más la estructura.
En el interior de la célula, el plegamiento de las proteínas está auxiliado por otras proteínas especiales llamadas chaperonas , que hacen que el proceso de plegamiento sea más fiable e impiden que se asocien erróneamente a otras proteínas. Existen evidencias de que cuando se produce un plegamiento anómalo de las proteínas se pueden formar estructuras espaciales muy diferentes de la normal, a la que llamamos nativa. Estas estructuras se asocian con varias patologías degenerativas del sistema nervioso.
Cuando se rompen los enlaces débiles que mantienen las estructuras de orden superior a la primaria, las proteínas quedan desplegadas o desnaturalizadas , perdiendo su función. Así, si varía la temperatura, el pH o la cantidad de sales disueltas en el agua, las proteínas se desnaturalizan, al dificultarse la formación de puentes de hidrógeno y de los puentes salinos. Para algunas proteínas de pequeño tamaño este proceso es reversible, y cuando se recuperan las condiciones ambientales iniciales la proteína se vuelve a plegar espontáneamente a su forma original; decimos entonces que se renaturaliza.
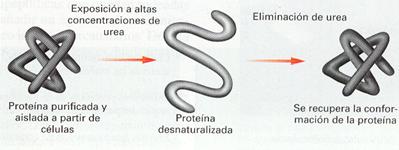
Desnaturalización-renaturalización.
Las propiedades de las proteínas, como la solubilidad, la desnaturalización y la especificidad dependen básicamente de la naturaleza de los radicales (-R) de los aminoácidos.
· Solubilidad. La solubilidad se debe a que solo los grupos -R polares o hidrófilos se halla localizados sobre la superficie externa de la proteína y establecen enlaces de hidrógeno con el agua; así, la proteína se rodea de una capa de agua que impide su unión con otras proteínas y, por tanto, su precipitación. En general, las proteínas fibrosas son insolubles en agua mientras que las globulares son hidrosolubles.
· Especificidad. Es la propiedad más característica de las proteínas. Esta especificidad se muestra a diversos niveles, siendo los más importantes la especificidad de especie y la especificidad de función.
· Especificidad de función. Reside en la posición que ocupan determinados aminoácidos de los que constituyen su secuencia lineal. Esta secuencia condiciona la estructura cuaternaria de la proteína, que es la responsable, en última instancia, de su función característica. Una pequeña variación en la secuencia de aminoácidos puede provocar la pérdida de funcionalidad de la proteína.
· Especificidad de especie. Existen proteínas que son exclusivas de cada especie. Lo más común, sin embargo, es que las proteínas que desempeñan la misma función en diferentes especies tengan una composición y estructura similares. Estas proteínas se llaman proteínas homólogas. Es el caso de la insulina, que se encuentra exclusivamente en vertebrados. La cadena A de la insulina es idéntica en la especie humana, el cerdo, el perro, el conejo y el cachalote.
· Capacidad amortiguadora. Las proteínas tienen un comportamiento anfótero, al igual que los aminoácidos que las forman. Debido a que pueden comportarse como ácidos o como bases, liberando o retirando H+ del medio, las proteínas son capaces de amortiguar las variaciones de pH del medio en que se encuentran.
1.5.4. Funciones de las proteínas.
Para mostrar el alcance del papel de las proteínas, basta con indicar que prácticamente no existe función biológica en la que de una forma u otra no esté implicada alguna proteína. Esta variedad funcional está acompañada por una gran especificidad: cada proteína realiza una función determinada y específica que depende de su estructura. Las proteínas son capaces de reconocer específicamente a otras moléculas e interactuar con ellas. Su actividad funcional deriva de esta capacidad.
Los principales tipos de funciones que desempeñan las proteínas son:
· Acción enzimática. Los enzimas son proteínas que catalizan (posibilitan, aceleran) casi todas las reacciones químicas que tienen lugar en las células.
· Transporte. Ciertas proteínas se unen a moléculas o iones específicos y se separan en otro lugar (un órgano, por ejemplo), lo que supone un transporte. Tal es el caso de la hemoglobina, que transporta 02 por la sangre. Las lipoproteínas transportan lípidos. Muchas proteínas de membrana trasladan de un lado a otro determinadas sustancias.
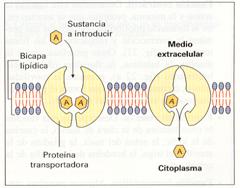
Proteínas transportadoras
· Movimiento y contracción. Existen proteínas, como la actina y la miosina, que intervienen en la contracción muscular. Unas estructuras celulares, los microtúbulos, dirigen movimientos intracelulares y constituyen los cilios y flagelos. Los microtúbulos están constituidos por la proteína tubulina.
· Soporte mecánico y estructural. Las fibras y otros elementos estructurales están formados por proteínas como el colágeno, la queratina y la elastina.
· Nutrición y reserva. La albúminas de la sangre o del huevo, la caseína de la leche o las proteínas de las semillas, son fuentes de componentes aminoácidos.
· Inmunidad. Las inmunoglobulinas son proteínas de defensa específicas que se unen y neutralizan virus, bacterias o sustancias extrañas.
· Regulación hormonal. Algunas hormonas como la paratiroidea, la hormona del crecimiento o la insulina, son proteínas.
· Regulación de ladiferenciación. Existen proteínas que reprimen o activan la expresión genética en la diferenciación celular.
· Recepción y transmisión de señales. Ciertas proteínas de membrana son receptores de hormonas u otras moléculas señal. La transmisión del impulso nervioso se realiza gracias a las proteínas de membrana de las neuronas que reciben neurotransmisores. La rodopsina es una proteína de recepción de la luz en el ojo.
Existen incluso proteínas anticongelantes en ciertos peces antárticos.
En definitiva la versatilidad funcional de las proteínas parte de la base de las diferentes estructuras que se pueden formar con un conjunto de sólo 20 aminoácidos.