Proteínas 3 (soluciones)
1.- ¿A qué se llama estructura de una proteína?
Se llama estructura de una proteína a la conformación tridimensional que presenta para realizar eficientemente su función metabólica. La estructura nativa es la que adopta una vez sintetizada en la célula y es característica de cada proteína. Se consideran los siguientes niveles de organización estructural: primario, secundario, terciario y cuaternario.
Nota.- En algunos apuntes universitarios se ha sugerido un nivel quinario, que viene dado por la asociación de proteínas que ya son funcionales, por ejemplo, el complejo multienzimático denominado ácido graso sintasa.
2.- ¿A qué se llama estructura primaria?
La estructura primaria es el nivel de organización más sencillo y corresponde al orden de los residuos en la cadena polipeptídica, es decir, a la secuencia lineal de los aminoácidos que la forman. Generalmente, el número de aminoácidos que forman una proteína oscila entre 80 y 300. La estructura primaria es la que condiciona los niveles superiores de organización.
3.- ¿Quién fue el primero en determinar la secuencia de una proteína?
El bioquímico inglés Frederick Sanger, mediante métodos químicos muy laboriosos, fue el primero en determinar la secuencia de un polipéptido, concretamente la insulina, descubriendo el orden en el que estaban unidos los 51 aminoácidos.
Una vez conocida la secuencia de la insulina, técnicos chinos fueron los primeros en sintetizarla en el laboratorio.
Actualmente la secuenciación de una proteína se realiza de forma automática en un aparato llamado secuenciador de aminoácidos.
4.- ¿Cuántas secuencias proteicas de 70 residuos podrían existir? ¿Y si sólo hubiera tres aminoácidos diferentes?
Como hay 20 aminoácidos posibles en cada posición, el resultado es 2070 (20 elevado a 70).
En el segundo caso: 370 (3 elevado a 70).
5.- Internet (busque en “Nobelprize.org”). ¿Quién fue galardonado con el Nobel de Química en 1958 y cuál fue el motivo de la concesión?
Frederick Sanger, por su trabajo sobre la estructura de las proteínas, especialmente la de la insulina.

Nota.- Sanger también fue galardonado con el Nobel de Química en 1980 por sus investigaciones sobre la secuenciación de bases en los ácidos nucleicos.
6.- Indique alguna utilidad derivada de la comparación de estructuras primarias. ¿Qué son los aminoácidos invariantes?
• La comparación de la estructura primaria de una misma proteína en especies distintas tiene gran interés desde el punto de vista filogenético. Evolutivamente, cuanto más alejadas estén las especies analizadas, más diferencias se podrán observar en la secuencia de proteínas análogas, por ejemplo, del citocromo c.
• Pese a las diferencias observadas, a menudo se encuentra que algunos aminoácidos, llamados invariantes o conservados, aparecen siempre en idéntica posición en las especies analizadas. Estos aminoácidos suelen ser indispensables para que la proteína adopte la estructura espacial correcta y desempeñe su función concreta. Cualquier mutación que afecte a estas posiciones es evolutivamente poco ventajosa e incluso letal para el organismo, por lo que tiende a ser eliminada en el proceso de selección natural.
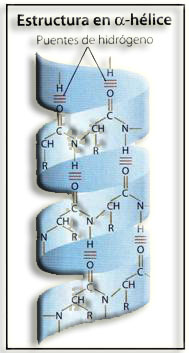
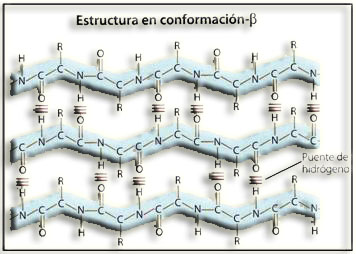
7.- ¿A qué se llama estructura secundaria?
La estructura secundaria se refiere al plegamiento que la cadena polipeptídica adopta gracias a la formación de enlaces por puente de hidrógeno entre los grupos −CO− y −HN− de diferentes enlaces peptídicos:
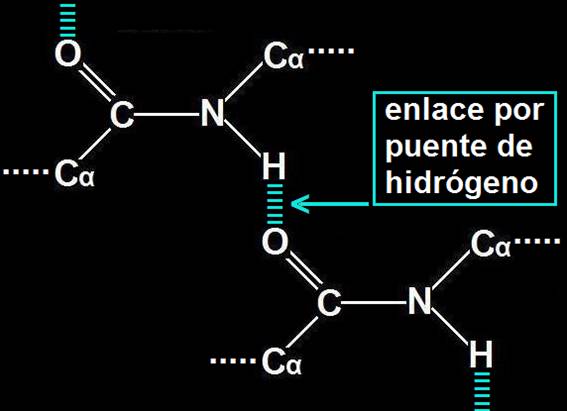
Debido a las repeticiones de esta interacción, la cadena puede adoptar conformaciones características, principalmente, la hélice α y la hoja plegada o lámina ß. Las estructuras desorganizadas y los giros sirven de nexo entre las mismas.
8.- Copie o pegue en su cuaderno un modelo de hélice α y de hoja plegada β (consulte su libro o Internet).
|
|
|
|
9.- ¿Cuáles son las características de la hélice alfa y quién realizó este descubrimiento?
La hélice α, descrita en 1951 por el químico estadounidense Linus Pauling, presenta unos parámetros característicos: cada vuelta completa equivale a una distancia o “paso” de 0,54 nm y contiene 3,6 residuos. Los radicales o cadenas laterales de los aminoácidos se sitúan en la parte externa del helicoide, circunstancia que minimiza los posibles impedimentos estéricos.
10.- Identifique la siguiente estructura y nombre las partes numeradas.
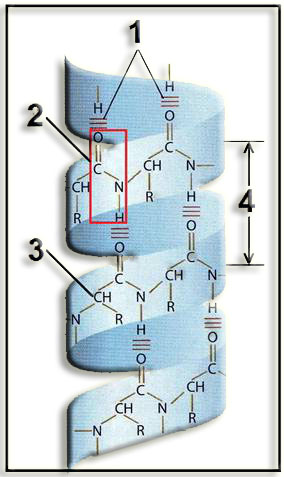
Se trata de una estructura secundaria: hélice alfa.
1 = enlaces por puente de hidrógeno.
2 = enlace peptídico.
3 = carbono alfa de uno de los residuos.
4 = paso de la hélice: 0,54 nm.
11.- ¿Influye el pH en la estabilidad de la hélice alfa?
Los aminoácidos básicos y ácidos (Lys, Arg, Asp, Glu) también desestabilizan la hélice alfa porque los enlaces de hidrógeno pierden relevancia al ser más débiles que las interacciones de los radicales ácidos y básicos, de forma que la estabilidad de la hélice α está condicionada por los valores de pH en los que los grupos ionizables no están cargados.
12.- ¿Cuántos aminoácidos hay en 5 vueltas de una hélice alfa y cuál es la longitud de la misma?
Como en cada vuelta hay 3,6 residuos, en 5 vueltas habrá 18 aminoácidos.
Dado que a cada vuelta le corresponde un paso de 0,54 nm, la medida para las 5 vueltas es 2,7 nm.
13.- Internet (busque en “Nobelprize.org”). ¿Quién fue galardonado con el Nobel de Química en 1954 y cuál fue el motivo de la concesión?
Linus Pauling fue premiado con el Nobel de Química de 1954 por sus investigaciones sobre la naturaleza de los enlaces químicos.

Nota.- Pauling también recibió el Nobel de la Paz en 1962, por su campaña contra las pruebas nucleares terrestres. Linus Pauling falleció a los 93 años de edad (1901-1994).
14.- Identifique la siguiente estructura y nombre las partes numeradas.
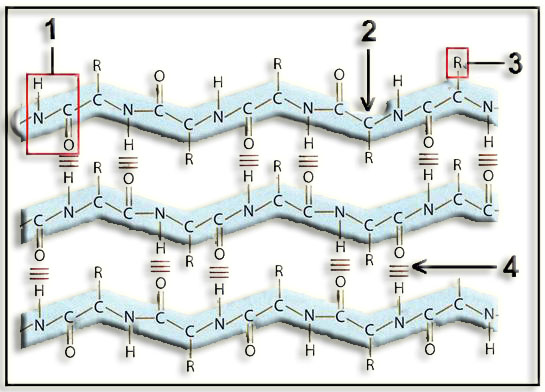
Se trata de una estructura secundaria: hoja plegada o lámina β.
1 = enlace peptídico.
2 = carbono alfa (en todos ellos falta un H).
3 = grupo radical o cadena lateral de un residuo.
4 = enlace por puente de hidrógeno.
15.- ¿Qué entiende por conformación al azar?
Se habla de conformación al azar cuando en algunas proteínas, o en ciertas regiones de las mismas, no existen interacciones de suficiente consideración como para que se pueda distinguir un nivel de organización superior a la estructura primaria.
16.- ¿Qué son las estructuras supersecundarias?
En las proteínas globulares es frecuente encontrar asociaciones de hélices alfa y láminas beta, con una disposición característica que se repite en diferentes regiones de la cadena peptídica. Son los llamados motivos estructurales o estructuras supersecundarias. Algunos motivos están formados por hélices α, láminas β o combinaciones de las dos. Así, por ejemplo, el motivo estructural βαβ.
17.- (Busque en Internet). ¿Qué es la estructura de Rossmann?
Es una estructura supersecundaria caracterizada por la disposición paralela y alternante de hélices α y láminas β. Este motivo estructural suele ser frecuente en proteínas que se unen a nucleótidos.
18.- ¿Qué son dominios?
Los dominios proteicos son regiones diferenciadas dentro de la cadena peptídica que actúan como unidades autónomas de plegamiento, o sea, pueden plegarse independientemente del resto.
Los dominios se pliegan por separado a medida que se sintetiza la cadena polipeptídica. Estas regiones o dominios constituyen para algunos autores un nivel estructural intermedio entre las estructuras secundaria y terciaria. Es la asociación de los distintos dominios la que origina la estructura terciaria.
19.- ¿A qué se llama estructura terciaria?
El nivel de organización estructural terciario se caracteriza por la disposición espacial de las distintas estructuras secundarias de una cadena polipeptídica. La estructura terciaria es la responsable directa de las propiedades biológicas de las proteínas y la mayoría de las mismas son funcionales una vez alcanzado este nivel.
El plegamiento tridimensional propio de la estructura terciaria se mantiene estable gracias a varios tipos de enlaces, que se establecen entre los grupos radicales o cadenas laterales de los aminoácidos. La mayoría de las proteínas son funcionales una vez alcanzado el nivel terciario.
20.- Indique las interacciones propias del nivel estructural terciario.
Entre los grupos radicales de los aminoácidos tienen lugar las interacciones siguientes:
-) Enlaces disulfuro (-S-S-), que se establecen entre los grupos SH de sendas cisteínas.
-) Enlaces amida (OC−NH), que se pueden establecer entre los grupos carboxilo y amino de las cadenas laterales de los aminoácidos ácidos (Asp, Glu) y básicos (Lys).
-) Interacciones electrostáticas entre grupos R+ y R−.
-) Enlaces por puente de hidrógeno entre grupos polares.
-) Interacciones hidrofóbicas y fuerzas de Van der Waals entre radicales apolares (alifáticos y aromáticos).
21.- Copie o pegue en su cuaderno un modelo de plegamiento tridimensional propio de una estructura terciaria (consulte su libro o Internet).

22.- ¿A qué se llama estructura cuaternaria?
El nivel estructural cuaternario es propio de las proteínas formadas por más de una cadena polipeptídica, que se unen mediante enlaces débiles y, en ocasiones, puentes disulfuro (caso de las inmunoglobulinas).
Cada una de las cadenas polipeptídicas recibe el nombre de protómero o subunidad. El número es variable, por ejemplo, 2 en la hexoquinasa, 4 en la hemoglobina, 12 en la glutamina sintetasa, etc. Los protómeros pueden ser iguales o distintos y el ensamblaje se realiza de forma espontánea.
La estructura cuaternaria modula la actividad biológica de la proteína y la separación de las subunidades conlleva a menudo la pérdida de funcionalidad.
23.- ¿Qué son proteínas fibrosas y globulares? Cite ejemplos.
• Las proteínas fibrosas se caracterizan por presentar una forma alargada debido a que una de las dimensiones es mucho mayor que las otras dos, por ejemplo: colágeno, elastina, etc. En proteínas con estructura terciaria de tipo fibroso, la estructura cuaternaria resulta de la asociación de varias hebras para formar una fibra.
• Las proteínas globulares son más frecuentes y tienen forma esferoidal, por ejemplo: mioglobina, hemoglobina, lisozima, inmunoglobulinas, etc.
24.- Internet (busque en “Nobelprize.org”). ¿Quiénes fueron galardonados con el Nobel de Química en 1962 y cuál fue el motivo de la concesión?
Max F. Perutz y John C. Kendrew, por sus estudios sobre las estructuras de las proteínas globulares (particularmente, la hemoglobina y la mioglobina).
|
|
|
|
|
Kendrew |
|
Perutz |
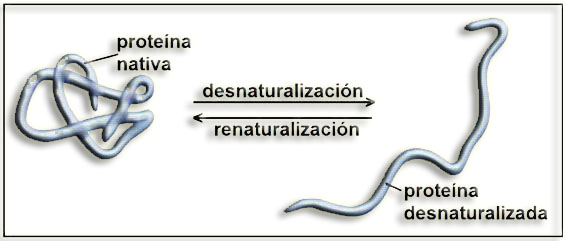
25.- ¿En qué consiste la desnaturalización? Haga un esquema.
La desnaturalización de una proteína consiste en la pérdida total o parcial de los niveles de organización estructural superiores al primario. Cuando desaparece la estructura nativa característica de una proteína, ésta pierde su función y suele precipitar.
La desnaturalización conlleva la pérdida del plegamiento tridimensional y suele ser un proceso irreversible, causado principalmente por aumentos de la temperatura o por variaciones significativas del pH o de la cantidad de sales disueltas. Sin embargo, para algunas proteínas de pequeño tamaño el proceso es reversible y se llama renaturalización, adoptando de nuevo el plegado original cuando las condiciones del medio vuelven a ser iguales o muy similares a las que había antes de la alteración.
26.- ¿Qué pasa al cocer o freír un huevo? ¿Y al ponerlo en el congelador de un frigorífico? ¿A qué se debe la leche “cortada”?
El aumento de la temperatura provoca la desnaturalización de la ovoalbúmina y otras proteínas del huevo, siendo este proceso irreversible. Sin embargo, el frío no provoca la desnaturalización y, al cascarlo, el huevo muestra su aspecto normal.
La leche cortada se debe a la desnaturalización de la caseína.
27.- ¿Qué son las proteínas de choque térmico?
Las proteínas de choque térmico (HSP, del inglés Heat Shock Proteins) se descubrieron en 1962 en células de las glándulas salivales de Drosophila melanogaster, cuando estas moscas eran sometidas a incrementos térmicos.
Las HSP son un conjunto de proteínas que producen las células, tanto de organismos procariotas como eucariotas, cuando encuentran en el medio ambiente situaciones de estrés metabólico, tales como: aumento o disminución de la temperatura, variaciones significativas en el pH o en la presión osmótica, falta de oxígeno, presencia de sustancias tóxicas, etc. Estos factores influyen en la alteración de la estructura nativa de las proteínas, rompiendo enlaces, desplegando las cadenas, exponiendo los radicales hidrofóbicos al agua y, en suma, provocando la pérdida de función de la proteína.
Algunos autores llaman a las HSP proteínas anti-estrés, pues aunque están siempre presentes en las células su concentración aumenta en situaciones de estrés.
Su función es favorecer que la estructura espacial de otras proteínas sea correcta y no haya pérdida de funcionalidad, ayudando también a marcar para ser destruidas las proteínas desnaturalizadas, o bien, a conservarlas ante una posible renaturalización.
28.- ¿Qué son las chaperonas?
Las chaperonas son unas proteínas que ayudan al plegamiento de otras recién sintetizadas en la célula. Actúan durante la biosíntesis de proteínas y sólo se unen a la nueva cadena para ayudar en su plegamiento, ensamblaje y transporte celular hasta donde la proteína realiza su función.
Las chaperonas empezaron a conocerse a finales de la década de los setenta y hoy su número es elevado y va en aumento. El subgrupo más estudiado es el de las chaperoninas, que son agregados formados por proteínas de masa molecular cercana a 60 kDa (60000 u). Todas las chaperoninas conocidas hasta la fecha comparten una estructura similar: un cilindro compuesto por uno o dos anillos, cada uno de los cuales delimita una cavidad, que es el lugar donde se produce el plegamiento de las proteínas.
29.- ¿Conoce proteínas que intervengan en el plegamiento de otras?
• Las chaperonas aumentan la eficacia del proceso de plegamiento de otras proteínas (ver la cuestión anterior).
• Las disulfuro isomerasas catalizan la ruptura y formación de puentes disulfuro entre residuos de cisteína, posibilitando los enlaces más adecuados para que el plegamiento de la proteína auxiliada sea el correcto.
• Las cis-trans prolil isomerasas aumentan la velocidad del plegamiento en la cadena polipeptídica al facilitar dicho proceso mediante interconversiones cis-trans de enlaces peptídicos de residuos de prolina.
30.- Internet (busque en “Nobelprize.org”). ¿Quién fue galardonado con el Nobel de Medicina 1997? Añada un comentario sobre el descubrimiento.
Stanley B. Prusiner, por su investigación sobre los priones.

Los priones constituyen agregados de proteínas mal plegadas que son capaces de provocar un plegamiento defectuoso en las proteínas priónicas normales, originando alteraciones neurodegenerativas contagiosas en diversas especies animales, como la encefalopatía espongiforme.
La forma normal se designó con la abreviatura PrPC (proteína prion celular) y la forma alterada, PrPSc (de scrapie, nombre vulgar de dicha encefalopatía). Esta proteína alterada forma agregados dentro de las células nerviosas a las que destruye.
La proteína priónica humana tiene 253 aminoácidos y su estructura normal presenta un 40% de hélice α y carece de lámina β, pero por razones no bien conocidas cambia la estructura y se transforma en patológica, con el 20% de hélice α y el 50% de hoja plegada o lámina β. Cada proteína alterada se une a otra normal, modificándola, y así sucesivamente.
Las proteínas alteradas o patológicas son resistentes a la acción de las proteasas, por lo que se acumulan en las células causando su destrucción. Así, por ejemplo, las enfermedades de Creutzfeld-Jacob y de las “vacas locas” (transmisible a los humanos) provocan una rápida progresión del deterioro mental y diversos trastornos motores.
Nota.- La patología no se desarrolla en ratones carentes del gen que codifica la forma normal del prion.
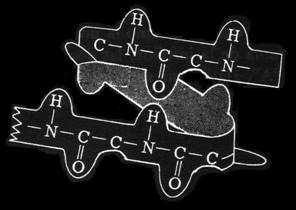
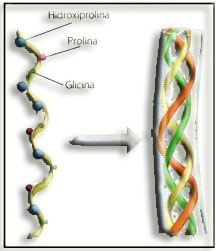
31.- Identifique estos dos esquemas.
|
|
|
|
• El primero representa un fragmento de hélice alfa. Se observa la interacción (puente de hidrógeno) entre el −CO− y el −HN− de diferentes enlaces peptídicos, distantes 4 residuos.
• En el otro esquema se ve una hélice con la glicina que se repite periódicamente cada tres residuos, composición propia del colágeno (un tercio de los residuos son de Gly), y la asociación característica en triple hélice, posibilitada precisamente por el pequeño tamaño de dicho aminoácido.
32.- Cite fuentes alimentarias de proteínas. Indique el valor energético de 10 g de proteína. ¿Qué problema presentan las proteínas de origen vegetal?
• Fuentes dietéticas de proteínas: carnes, derivados cárnicos, pescados, huevos, quesos, legumbres, frutos secos, etc.
• Desde el punto de vista energético, cada gramo de proteína proporciona 4 kilocalorías. Resultaría: 40 kcal (este valor se puede multiplicar por 4,18 y expresarlo en kilojulios (kJ).
• Las proteínas de origen animal, por ejemplo, la caseína de la leche y del queso, la albúmina del huevo y la miosina del músculo son fácilmente digeribles y aportan los 20 aminoácidos. Sin embargo, las proteínas de origen vegetal suelen ser deficientes en aminoácidos esenciales: la lisina escasea en los cereales y la cisteína y la metionina, en las legumbres. Este inconveniente se salva mezclando estos alimentos.
33.- ¿Qué enzimas intervienen en la digestión de las proteínas y cuál es el resultado?
• Las proteasas digestivas son las enzimas que hidrolizan los enlaces peptídicos y se pueden agrupar en endopeptidasas y exopeptidasas, según que corten los enlaces situados en el interior o en los extremos de la cadena, respectivamente.
Pepsina, tripsina y quimotripsina son ejemplos de endopeptidasas. Las exopeptidasas de dividen en aminopeptidasas y carboxipeptidasas, que hidrolizan a partir del extremo amino o del carboxilo.
• El resultado de la digestión de las proteínas es una mezcla de aminoácidos libres y de oligopéptidos muy cortos, que son absorbidos por los enterocitos (células de la mucosa intestinal), en cuyo interior se completa la hidrólisis gracias a la acción de las di, tri y tetrapeptidasas citosólicas.
34.- Clasificación de las proteínas. Cite ejemplos.
Las proteínas se suelen dividir en simples u holoproteínas y conjugadas, compuestas o heteroproteínas.
• Las holoproteínas están formadas únicamente por aminoácidos. Dicho de otra forma: son aquellas que por hidrólisis total dan sólo aminoácidos. Si tienen forma esferoidal se llaman genéricamente proteínas globulares (albúminas, inmunoglobulinas, protaminas, histonas). Las proteínas fibrosas o escleroproteínas presentan una forma alargada, son insolubles en agua y desempeñan funciones estructurales (colágeno, elastina, queratina, fibroína).
• Las heteroproteínas están formadas por la cadena peptídica unida a un grupo “prostético” (no proteico) y, según la naturaleza del mismo, se considera:
- Glucoproteínas (unión de proteína y glúcido).
- Lipoproteínas (unión de proteína y lípidos).
- Nucleoproteínas (el grupo prostético es ácido nucleico).
- Cromoproteínas (el grupo prostético es un pigmento, esto es, una sustancia orgánica coloreada que contiene un átomo metálico).
- Hemoproteínas (el grupo prostético es la ferroprotoporfirina).
35.- Funciones biológicas de las proteínas.
Las proteínas desempeñan una amplia variedad de funciones:
• Enzimática. Las enzimas son proteínas globulares que actúan como biocatalizadores muy específicos, posibilitando las reacciones químicas de todos los procesos metabólicos.
• Transporte. Los transportadores biológicos son siempre proteínas. La hemoglogina y la mioglobina transportan oxígeno. La transferrina y las lipoproteínas transportan, respectivamente, el hierro y los lípidos por la sangre. También existen numerosas proteínas encargadas del transporte de sustancias a través de la membrana plasmática.
• Defensiva. En los vertebrados las más importantes son las inmunoglobulinas (anticuerpos) cuyo objetivo es mantener el buen estado inmunológico del organismo. El llamado sistema del complemento es un conjunto de proteínas plasmáticas que una vez activadas pueden destruir ciertos patógenos.
Por otra parte, las restrictasas o endonucleasas de restricción cortan el ADN de los virus bacteriófagos infectantes, por lo que defienden a la bacteria de los efectos del ADN extraño.
• Reguladora. Muchas proteínas actúan como reguladores de la expresión génica, pues se unen al ADN y de esta forma controlan la transcripción. Posteriormente, tras la correspondiente traducción, la célula dispondrá de todas las proteínas necesarias para desempeñar normalmente sus funciones.
Además, las diversas fases del ciclo celular están reguladas principalmente por diversas combinaciones de unas proteínas llamadas ciclinas y quinasas dependientes de ciclina (Cdk).
• Transducción de señales. Localizadas en las membranas celulares hay proteínas receptoras específicas que se unen a moléculas concretas y generan señales intracelulares. Los fenómenos de transducción, esto es, cambio en la naturaleza físico-química de señales, están mediados por proteínas. Así, por ejemplo, un receptor hormonal capta una señal química, o sea, una hormona y seguidamente se genera una serie de modificaciones en el estado funcional de la célula.
• Hormonal. Así, por ejemplo, la somatotropina u hormona del crecimiento, integrada por 187 aminoácidos, que se origina en la hipófisis anterior (adenohipófisis) y cuya función se relaciona con el desarrollo somático.
• Reserva. La ovoalbúmina del huevo, la lactoalbúmina de la leche, la gliadina del trigo y la hordeína de la cebada, son ejemplos de proteínas que almacenan aminoácidos como elementos nutritivos.
• Estructural. Las células poseen un citoesqueleto de naturaleza proteica que constituye el principal armazón estructural.
Por otra parte, las escleroproteínas actúan como elementos estructurales del organismo: colágeno (tendones, hueso, cartílago), elastina (ligamentos), queratinas (piel, pelos, plumas, uñas, pezuñas). Las fibras de colágeno son muy importantes para proporcionar resistencia mecánica tanto a la tracción como a la compresión. El colágeno es la proteína más abundante en mamíferos.
• Homeostática. Las proteínas intracelulares y del medio intercelular posibilitan el equilibrio osmótico e intervienen junto con otros sistemas amortiguadores o tampones que mantienen el pH constante.
• Motilidad. Todas las funciones de motilidad de los seres vivos están relacionadas con las proteínas. Así, la contracción muscular se debe sobre todo a la interacción de dos proteínas, la actina y la miosina. El movimiento de la célula mediante cilios y flagelos está relacionado con las proteínas que forman los microtúbulos.
• Despolimerizacón. Las proteínas catanina y catastrofina, presentes en muchas células, favorecen la despolimerización de los microtúbulos, separando los protofilamentos integrantes (constituidos por una proteína llamada tubulina, dispuesta en heterodímeros: tubulina α y tubulina β).
• Auxiliadora o modeladora. Las proteínas de unión, acompañantes o chaperonas (del inglés, chaperone) favorecen el correcto plegamiento de las proteínas que la célula sintetiza.
• Marcaje. La ubiquitina es una proteína pequeña (76 aminoácidos) presente en el citosol de muchas células, que se une a otras y las “marca” para ser degradadas, por ejemplo, por presentar un plegamiento incorrecto.
• Degradación. Los proteasomas son unos complejos proteicos en forma de cilindro hueco, con actividad proteasa. En su interior tiene lugar la degradación de la proteína previamente ubiquitinada.